Cách viết công thức cấu tạo của các phân tử Chuyên đề Hóa học lớp 10: Cách viết công thức cấu tạo của các phân tử được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Tải Cách Viết Công Thức Nhanh Nhất
Bạn đang đọc: Cách viết công thức cấu tạo của các phân tử và Viết công thức cấu tạo của các hợp chất hữu cơ lớp 10
Tóm tắt nội dung bài viết
A. Phương pháp và ví dụ
Lý thuyết và giải pháp giải
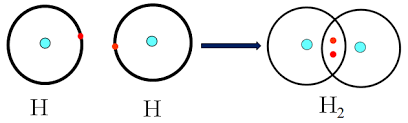
a. Liên kết cộng hóa trị hình thành giữa các nguyên tử giống nhau
Sự hình thành đơn chất H2
 Mỗi chấm bên kí hiệu nguyên tố trình diễn một electron ở lớp ngoài cùng .Ký hiệu H : H là công thức electron ; H-H là công thức cấu tạo .Giữa 2 nguyên tử hidro có 1 cặp electron link bộc lộ bằng ( – ) đó là link đơn .
Mỗi chấm bên kí hiệu nguyên tố trình diễn một electron ở lớp ngoài cùng .Ký hiệu H : H là công thức electron ; H-H là công thức cấu tạo .Giữa 2 nguyên tử hidro có 1 cặp electron link bộc lộ bằng ( – ) đó là link đơn .
Liên kết cộng hóa trị là gì?
Liên kết cộng hóa trị là link được tạo nên giữa hai nguyên tửu bằng một hay nhiều cặp electron chung .Mỗi cặp electron chung tạo nên 1 link cộng hóa trị, nên ta có link đơn ( trong phân tử H2 ), link ba ( trong phân tử N2 )
- Viết cấu hình e của các nguyên tử tạo hợp chất
- Tính nhẩm số e mỗi nguyên tử góp chung = 8 – số e lớp ngoài cùng
- Biểu diễn các e lớp ngoài cùng và các cặp e chung (bằng các dấu chấm) lên xung quanh kí hiệu nguyên tử ⇒ công thức electron
- Thay mỗi cặp e chung bằng 1 gạch ngang ta được công thức cấu tạo
Lưu ý:
- Khi hai nguyên tử liên kết mà trong đó có một nguyên tử A đạt cấu hình bền còn nguyên tử B kia chưa thì lúc này A sử dụng cặp electron của nó để cho B dùng chung → hình thành liên kết cho nhận (hay phối trí) biểu diễn bằng → hướng vào nguyên tử nhận cặp electron đó.
- Khi có nhiều nguyên tử đều có thể đưa cặp electron ra cho nguyên tử khác dùng chung thì ưu tiên cho nguyên tử nào có độ âm điện nhỏ hơn.
- Khi viết công thức cấu tạo (CTCT) của:
* Axit có oxi : theo thứ tự+ Viết có nhóm H – O+ Cho O của nhóm H – O link với phi kim TT+ Sau đó cho phi km TT link với O còn lại nếu có .* Muối :+ Viết CTCT của axit tương ứng trước .+ Sau đó thay H ở axit bằng sắt kẽm kim loại .
Ví dụ minh họa
Ví dụ 1. Trình bày sự hình thành liên kết cho nhận trong các phân tử và sau H3O+, HNO3
Đáp án hướng dẫn giải
- Xét H3O+ ta có

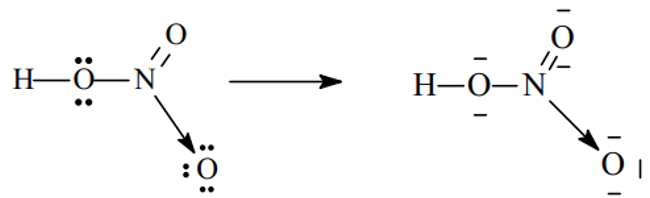
- Xét phân tử HNO3
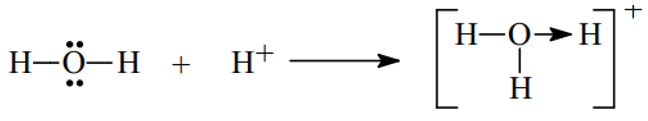
Xem thêm: làm thế nào để iphone 6 không bị đơ
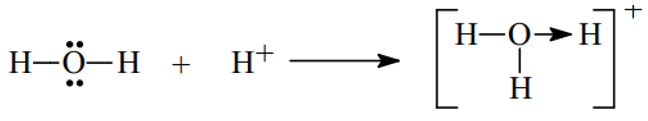 Sau khi hình thành những link cộng hóa trị, N ( chứ không phải O ) sẽ cho 1 cặp electron đến nguyên tử O thứ ba ( đang thiếu 2 e để đạt thông số kỹ thuật khí trơ ) hình thành link cho – nhận .Chú ý :
Sau khi hình thành những link cộng hóa trị, N ( chứ không phải O ) sẽ cho 1 cặp electron đến nguyên tử O thứ ba ( đang thiếu 2 e để đạt thông số kỹ thuật khí trơ ) hình thành link cho – nhận .Chú ý :
- Cấu tạo phân tử và biểu diễn với liên kết cho nhận là để phù hợp với quy tắc bát tử.
- Với nguyên tử cho cặp electron có 3 lớp trở lên, có thể có hóa trị lớn hơn 4 nên còn biểu diễn bằng liên kết cộng hóa trị.
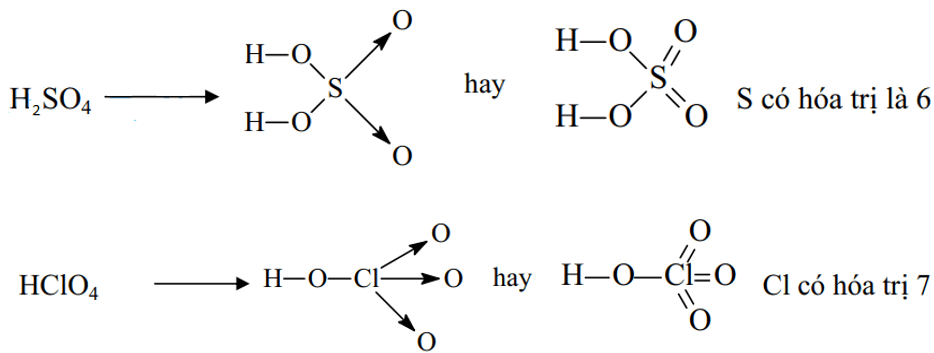
Ví dụ 2: Viết công thức cấu tạo của phân tử H2SO4 và HClO4 để thấy được quy tác bát tử chỉ đúng với 1 số trường hợp
Đáp án hướng dẫn giải

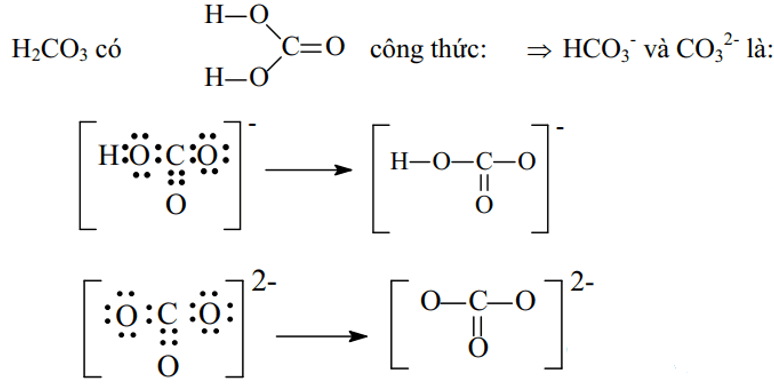
Ví dụ 3: Viết công thức electron và công thức cấu tạo các ion đa nguyên tử sau: CO32-, HCO3-
Đáp án hướng dẫn giải

Ví dụ 4. Viết công thức cấu tạo của các chất sau
Cl2O, Cl2O5, HClO3 .
Đáp án hướng dẫn giải
Cl2O :
 Cl2O5 :
Cl2O5 :
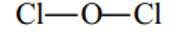
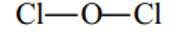 HClO3 :
HClO3 :
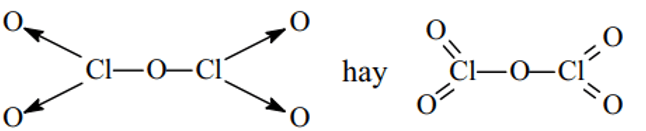
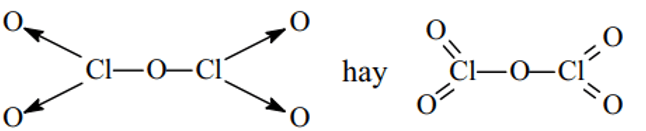
B. Bài tập vận dụng công thức cấu tạo của các phân tử
Câu 1. Hãy viết công thức electron và công thức cấu tạo của các phân tử sau: PH3, SO2
Câu 2. Viết công thức electron, công thức cấu tạo của HClO, HCN, HNO2.
Câu 3. Viết công thức cấu tạo của các phân tử và ion sau: H2SO3, Na2SO4, HClO4, CuSO4, NaNO3, CH3COOH, NH4NO3, H4P2O7.
Câu 4. Viết công thức electron, công thức cấu tạo của các phân tử:NH3, C2H2, C2H4, CH4, Cl2, HCl, H2O.
Xem thêm: làm thế nào để iphone 6 không bị đơ
Câu 5. Viết công thức cấu tạo của các phân tử và ion sau: NH4+, Fe3O4, KMnO4, Cl2O7
Câu 6. Viết công thức electron và công thức cấu tạo các chất sau:HNO3, Al(OH)3, K2Cr2O7, N2O5, Al2S3, H2CrO4, PCl5
Trên đây VnDoc đã ra mắt Cách viết công thức cấu tạo của những phân tử tới những bạn. Để có tác dụng học tập tốt và hiệu suất cao hơn, VnDoc xin trình làng tới những bạn học viên tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải .
Source: http://wp.ftn61.com
Category: Thủ Thuật


Để lại một bình luận