Axit Clohidric (HCl) là loại axit gì, có cấu tạo ra sao? Trong các phản ứng hóa học, Axit Clohidric đóng vai trò gì? Phương pháp điều chế HCl trong phòng thí nghiệm được triển khai như thế nào? Các lưu ý cần bỏ túi khi thực hiện điều chế? Tất cả các thắc mắc về Axit Clohidric sẽ được giải đáp ở bài sau.
Tóm tắt nội dung bài viết
- Khái niệm về Axit Clohidric (HCl)
- Tính chất vật lý của hợp chất Axit Clohidric (HCl)
- Tính chất hóa học của hợp chất Axit Clohidric (HCl)
- Đổi màu quỳ tím
- Axit Clohidric (HCl) tác dụng với bazo tạo ra muối và nước
- Axit Clohidric (HCl) tác dụng với oxit kim loại tạo ra muối và nước
- Tác dụng với kim loại (những kim loại đứng trước Hidro trong dãy hoạt động hóa học)
- Axit Clohidric (HCl) tác dụng với dung dịch muối cho ra muối mới và axit mới
- Một số tác dụng khác
- Cách điều chế HCl trong phòng thí nghiệm
- Điều chế HCl công nghiệp
- Các ứng dụng có mặt của Axit Clohidric (HCl)
- Các lưu ý trong quá trình bảo quản, sử dụng Axit Clohidric (HCl)
- Lưu ý sử dụng dung dịch Axit Clohidric (HCl)
- Bảo quản dung dịch Axit Clohidric (HCl)
Khái niệm về Axit Clohidric (HCl)

Axit Clohidric (HCl) được mệnh danh là một trong những loại hóa chất hàng đầu trong nền công nghiệp hóa chất hiện nay. HCl ngoài danh pháp hóa học chính còn có các tên gọi khác như: Axit muriatic, Axit hidroclorua, Cloran. Nó là nguyên liệu, là chất xúc tác của rất nhiều lĩnh vực, ví dụ như: công nghiệp hóa học, công nghiệp dược phẩm, công nghiệp cơ khí,… Đây là một dạng axit vô cơ có tính oxi hóa cực kỳ mạnh.
HCl có tính oxi hóa mạnh, do đó nó ăn mòn rất nhiều thứ khi tiếp xúc phải. Nếu da người tiếp xúc trực tiếp với HCl nồng độ đậm đặc hoàn toàn có thể gây bỏng. Các cơ quan khi bị tổn thương bởi axit thì rất khó phục sinh .
Tính chất vật lý của hợp chất Axit Clohidric (HCl)
Axit Clohidric (HCl) như đã nói ở trên là một axit mạnh, nó không có màu, mùi xốc, có thể tan nhanh trong nước tạo thành dung dịch có tính axit. Ở điều kiện thường, Axit Clohidric (HCl) sẽ tồn tại ở hai dạng chính là dạng lỏng và dạng khí.So với không khí thì nó nặng hơn không khí.
Bạn đang đọc: Phương Trình Điều Chế HCl Trong Phòng Thí Nghiệm
 Ở thời gian hiện tại, nồng độ axit HCl đậm đặc nhất đo được là 40 %, ở nồng độ đậm đặc nhất, nó không còn là màu trong suốt mà ngả sang màu vàng nhạt hoặc vàng xanh lá. Khi ở nồng độ đậm đặc, Axit Clohidric ( HCl ) hoàn toàn có thể tạo thành những hạt sương mù .
Ở thời gian hiện tại, nồng độ axit HCl đậm đặc nhất đo được là 40 %, ở nồng độ đậm đặc nhất, nó không còn là màu trong suốt mà ngả sang màu vàng nhạt hoặc vàng xanh lá. Khi ở nồng độ đậm đặc, Axit Clohidric ( HCl ) hoàn toàn có thể tạo thành những hạt sương mù .
Độ hòa tan trong nước là : 725 g / L ở nhiệt độ 20 °C
Trọng lượng phân tử là : 36,5 g / mol .
Tính chất hóa học của hợp chất Axit Clohidric (HCl)
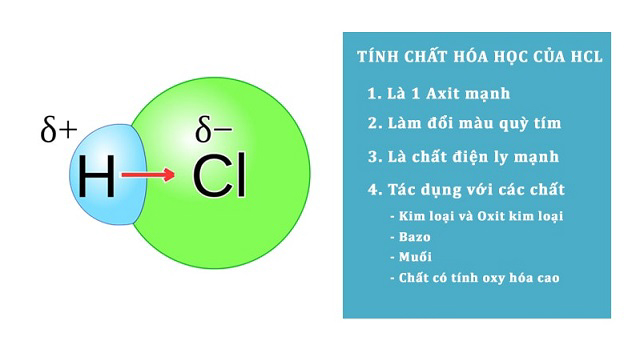 Axit Clohidric ( HCl ) là một loại axit có tính oxi hóa cực kỳ cao. Tính chất này của axit được biểu lộ qua những phản ứng hóa học đặc trưng. Một số đặc thù hóa học của axit như sau :
Axit Clohidric ( HCl ) là một loại axit có tính oxi hóa cực kỳ cao. Tính chất này của axit được biểu lộ qua những phản ứng hóa học đặc trưng. Một số đặc thù hóa học của axit như sau :
Đổi màu quỳ tím
Nhúng giấy quỳ tím vào dung dịch Axit Clohidric ( HCl ) tất cả chúng ta sẽ thấy hiện tượng kỳ lạ giấy quỳ tím chuyển sang màu đỏ. Đây là tín hiệu nhận ra rõ ràng một chất là axit mạnh .
Axit Clohidric (HCl) tác dụng với bazo tạo ra muối và nước
Cu ( OH ) 2 + 2HC l → CuCl2 + 2H2 O
Al ( OH ) 3 + 3HC l → AlCl3 + 3H2 O
Axit Clohidric (HCl) tác dụng với oxit kim loại tạo ra muối và nước
Fe3O4 + 8HC l → 4H2 O + FeCl2 + 2F eCl3
CuO + 2HC l → CuCl2 + H2O
Tác dụng với kim loại (những kim loại đứng trước Hidro trong dãy hoạt động hóa học)
Fe + 2HC l → FeCl2 + H2
Axit Clohidric (HCl) tác dụng với dung dịch muối cho ra muối mới và axit mới
AgNO3 + HCl → AgCl + HNO3
Na2CO 3 + 2HC l → 2N aCl + H2O + CO2
Một số tác dụng khác
HCl là chất lưỡng tính, biểu lộ cả năng lực khử và oxy hóa. Chúng bộc lộ tính oxi hóa khi tính năng sắt kẽm kim loại đứng trước H trong dãy :
MgO + 2H + 1C l → Fe + 2C l2 + H2O
Chúng biểu lộ tính khử khi tính năng với những chất oxi hóa mạnh hơn ví dụ như : MnO2, KClO3, KMnO4, K2Cr2O7, …
2KM n + 7O4 + 16H + 1C l → 2KC l + 2M n + 2C l2 + 5C l20 + 6H2 O
Cách điều chế HCl trong phòng thí nghiệm
Axit Clohidric ( HCl ) hoàn toàn có thể được điều chế với nồng độ lên tới 40 %. Cụ thể cách điều chế HCl trong phòng thí nghiệm như sau :
Cho muối Natri Clorua tính năng với dung dịch Axit Sunfuric đặc :
Phương trình điều chế HCl trong phòng thí nghiệm:
2N aCl rắn + H2SO4 đặc → Na2SO 4 + 2HC l
NaCl rắn + H2SO4 đặc → NaHSO4 + HCl
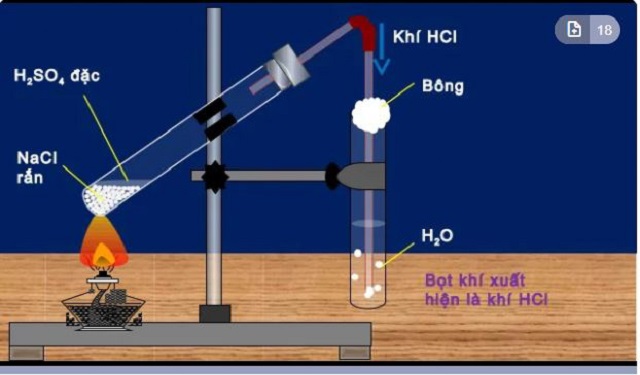
Phản ứng điều chế HCl trong phòng thí nghiệm cần có nhiệt độ cao để làm xúc tác, giúp cho phản ứng xảy ra nhanh chóng hơn.
||Xem thêm: Điều Chế HNO3 Trong Phòng Thí Nghiệm | Sơ đồ, phương trình
Điều chế HCl công nghiệp
Ngoài phương pháp điều chế HCl trong phòng thí nghiệm trên để thu được HCl phục vụ mục đích nghiên cứu thì hiện nay người ta còn sản xuất HCl bằng phương pháp công nghiệp, giúp thu được khối lượng HCl lớn hơn.
Phương trình điều chế Axit Clohidric ( HCl ) công nghiệp :
H2 + Cl2 → 2HC l ( đun nóng )
Các ứng dụng có mặt của Axit Clohidric (HCl)
Với tính oxi hóa mạnh, Axit Clohidric ( HCl ) được ứng dụng rất nhiều trong những nghành của đời sống. Cụ thể :
- Dùng Axit Clohidric ( HCl ) để tẩy bỏ gỉ sắt, gỉ thép ( Fe2O3 + Fe + 6HC l → 3F eCl2 + 3H2 O )
- Sản xuất những hợp chất hữu cơ, sản xuất nhựa PVC, than hoạt tính
( 2CH2 = CH2 + 4HC l + O2 → 2C lCH2CH2Cl + 2H2 O, gỗ + HCl + nhiệt → than hoạt tính )
- Sản xuất những hợp chất vô cơ ship hàng quy trình điều tra và nghiên cứu
- Sử dụng là keo, chất đông tụ, chất và lắng đọng kết tủa trong giải quyết và xử lý nước thải
- Dùng trong công nghiệp sản xuất giấy, tẩy trắng
- Mạ kẽm, mạ điện
- Sử dụng trong công nghiệp sản xuất thực phẩm, dược phẩm
- Vệ sinh nhà cửa, khử trùng, …
Có thể nói Axit Clohidric ( HCl ) là một trong những chất có tính ứng dụng rất thoáng đãng, có rất nhiều chuỗi hoạt động giải trí sản xuất cần đến sự tương hỗ của HCl .
| | Tham khảo : Javen là gì ? Cách Điều Chế Nước javen trong phòng thí nghiệm
Các lưu ý trong quá trình bảo quản, sử dụng Axit Clohidric (HCl)
Trong quy trình sản xuất và sử dụng Axit Clohidric ( HCl ), tất cả chúng ta cần cẩn trọng rất là, bởi đây là một loại axit mạnh, lỡ may tiếp xúc với da sẽ gây ra bỏng, hoại tử. Cụ thể :
Lưu ý sử dụng dung dịch Axit Clohidric (HCl)
Khi tiếp xúc trực tiếp với dung dịch Axit Clohidric ( HCl ), tất cả chúng ta cần phải mặc đồ bảo lãnh, đeo khẩu trang, đeo găng tay vừa đủ. Ngoài ra nếu là Axit Clohidric ( HCl ) đặc cần có thêm mặt nạ phòng độc, kính bảo lãnh .
Nếu không may Axit Clohidric ( HCl ) bị bắn, rơi ra bên ngoài thì phải dùng nước sạch xả, rửa trôi ngay .
Bị dính vào da nhanh gọn rửa với nước sạch để làm loãng nồng độ HCl, rửa sao cho hết cảm xúc ngứa trên tay, nếu dính một lượng nhiều thì nên nhanh gọn tới ngay cơ sở y tế .
Bảo quản dung dịch Axit Clohidric (HCl)
Để Axit Clohidric ( HCl ) tại những nơi thoáng, không có ánh nắng trực tiếp chiếu tới
Đảm bảo thực thi đủ giải pháp dữ gìn và bảo vệ, không gây đổ, vỡ, tràn axit ra môi trường tự nhiên
Nền kho chứa lát xi-măng
Không bảo quản axit với các chất dễ cháy, chất oxi hóa mạnh
Không để gần những sắt kẽm kim loại tránh thực trạng ăn mòn
Axit Clohidric (HCl) là một axit mạnh, có nhiều ứng dụng trong các lĩnh vực khác nhau. Chính vì thế, việc nắm vững cách điều chế HCl trong phòng thí nghiệm, công nghiệp giúp chúng ta hiểu rõ hơn về nó. Hãy theo dõi trang để cập nhật thêm nhiều tin tức thú vị nhé.
| | Bài viết tương quan khác :
Source: http://wp.ftn61.com
Category: Hỏi Đáp



Để lại một bình luận