Phương trình hóa học – Những điều bạn cần biết
Hóa học là một bộ môn quen thuộc với các bạn học sinh từ cấp Trung học cơ sở trở lên. Và Hóa học cũng là một bộ môn “gây thù chuốc oán” nhiều nhất với các bạn học sinh. Đây cũng là môn học sở hữu những tấm hình chế “có 1 – 0 – 2” bá đạo nhất.
Bạn đang đọc: Phương trình hóa học đầy đủ chi tiết nhất
Tóm tắt nội dung bài viết
- I. Tổng quan phương trình hóa học
- 1. Phương trình hóa học là gì?
- 2. Ý nghĩa phương trình hóa học
- 3. Các bước lập phương trình hóa học
- 4. Cách cân bằng phương trình hóa học
- 4.1. Phương pháp nguyên tử nguyên tố
- 4.2. Phương pháp hóa trị tác dụng
- 4.3. Phương pháp chẵn – lẻ
- 4.4. Cân bằng dựa vào nguyên tố chung nhất
- 4.5. Cân bằng theo phương pháp đại số
- II. Các công cụ cần dùng khi học môn Hóa học
- 1. Bảng tuần hoàn nguyên tố hóa học (Nguyên tố hóa học)
- 3. Bảng tính tan hóa học
- 4. Dãy điện hóa của kim loại
- III. Những lưu ý trong chương trình Hóa học
- 1. Hóa học 8
- 2. Hóa học 9
- 3. Hóa học 10
- 4. Hóa học 11
- 5. Hóa học 12
I. Tổng quan phương trình hóa học
1. Phương trình hóa học là gì?
Phương trình hóa học là phương trình trình diễn ngắn gọn phản ứng hóa học. ( Phản ứng hóa học là quy trình gây biến hóa từ một tập hợp chất hóa học này thành một tập hợp chất hóa học khác, phản ứng hóa học xảy ra khi có những điều kiện kèm theo thích hợp ). Trong phương trình hóa học, những chất sẽ được màn biểu diễn dưới dạng kí hiệu hóa học của chất đó. Chất ở bên trái mũi tên là chất tham gia và chất bên phải mũi tên là chất loại sản phẩm. Ví dụ : Hidro + Oxi -> Nước \ ( H_2 + O_2 \ rightarrow H_2O \ ) Chất tham gia : \ ( H_2 ; O_2 \ ) Chất loại sản phẩm : \ ( H_2O \ )
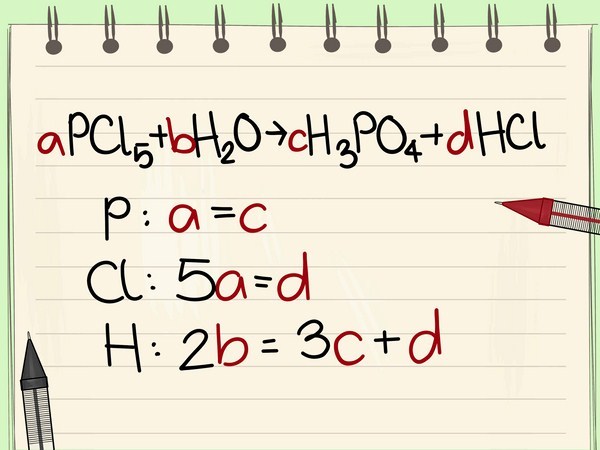
Cân bằng phương trình hóa học
2. Ý nghĩa phương trình hóa học
- Biểu diễn ngắn gọn những phản ứng hóa học
- Cho ta biết tỉ lệ về số nguyên tử, số phân tử giữa những chất và giữa những cặp chất trong phản ứng hóa học. Tỉ lệ này bằng tỉ lệ thông số giữa những chất trong phương trình hóa học.
3. Các bước lập phương trình hóa học
Để lập phương trình hóa học, những bạn cần làm lần lượt 3 bước sau :
-
Bước 1: Viết sơ đồ phản ứng (gồm kí hiệu hóa học của các chất tham gia và các chất sản phẩm)
-
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố, tìm số thích hợp đặt trước các công thức sao cho số nguyên tử các nguyên tố ở chất tham gia và chất sản phẩm phải bằng nhau.
-
Bước 3: Hoàn thành phương trình hóa học.
4. Cách cân bằng phương trình hóa học
Cân bằng phương trình hóa học là sự cân đối về số lượng nguyên tố của những chất trong hai vế của 1 phản ứng hóa học.
4.1. Phương pháp nguyên tử nguyên tố
Đây là chiêu thức đơn thuần nhất. Cân bằng theo cách này, ta sẽ viết những đơn chất khí dưới dạng nguyên tử riêng không liên quan gì đến nhau. Ví dụ : Cân bằng phương trình hóa học : \ ( P_2 + O_5 \ rightarrow P_2O_5 \ ) Để tạo thành 1 phân tử \ ( P_2O_5 \ ), ta cần 2 phân tử P và 5 phân tử O. => Ta được phương trình : \ ( 2P + \ dfrac { 5 } { 2 } O_2 \ rightarrow P_2O_5 \ ) Nhân những phân số với mẫu số chung nhỏ nhất ( ở phương trình này là 2 ) ta sẽ được phương trình hóa học ở đầu cuối : \ ( P + 5O _2 \ rightarrow P_2O_5 \ )
4.2. Phương pháp hóa trị tác dụng
Hóa trị công dụng là số hóa trị của những nhóm nguyên tử hay nguyên tử của những nguyên tố có trong Phản ứng hóa học. Các bước cân đối với chiêu thức này :
-
Bước 1: Xác định hóa trị tác dụng
\ ( BaCl_2 + Fe_2 ( SO_4 ) _3 \ rightarrow BaSO_4 + FeCl_3 \ ) Hóa trị công dụng lần lượt của phương trình trên từ trái qua phải là : I – II – III – I – I – I – III – II
-
Bước 2: Tìm bội số chung nhỏ nhất của các hóa trị tác dụng
Bội số chung nhỏ nhất của ( I, II, III ) là 6.
-
Bước 3: Lấy bội số chung nhỏ nhất chia cho các hóa trị ta sẽ được hệ số sau:
6 : 1 = 6 6 : 2 = 3 6 : 3 = 2
-
Bước 4: Thay vào phương trình phản ứng
4.3. Phương pháp chẵn – lẻ
Dựa vào nguyên tắc : Sau khi cân đối, số nguyên tử của nguyên tố ở chất tham gia phải bằng số nguyên tử của nguyên tố ở chất loại sản phẩm. Vậy nên nếu số nguyên tử của một nguyên tố ở 1 vế là số chẵn, thì nó cũng sẽ phải là số chẵn ở vế còn lại. Nên nếu số nguyên tử của nguyên tố còn lẻ, thì phải nhân đôi Thí dụ : \ ( FeS_2 + O_2 \ rightarrow Fe_2O_3 + SO_2 \ )
- Ở vế trái, số nguyên tử \ ( O_2 \ ) là chẵn
- Ở vế phải, số nguyên tử \ ( O_2 \ ) trong \ ( SO_2 \ ) là chẵn, nhưng số nguyên tử trong \ ( Fe_2O_3 \ ) lại là lẻ. => Phải nhân đôi. Sau đó, ta cân đối những thông số còn lại
\ ( 2F e_2O_3 \ rightarrow 4F eS_2 \ rightarrow 8SO _2 \ rightarrow 11O _2 \ ) Phương trình được cân đối : \ ( 4F eS_2 + 11O _2 \ rightarrow 2F e_2O_3 + 8SO _2 \ )
4.4. Cân bằng dựa vào nguyên tố chung nhất
Với giải pháp này, ta sẽ lựa chọn nguyên tố xuất hiện ở nhiều chất nhất trong phản ứng. Ví dụ : \ ( Cu + HNO_3 \ rightarrow Cu ( NO_3 ) _2 + NO + H_2O \ ) Nhận thấy, oxi là nguyên tố xuất hiện nhiều nhất trong phương trình phản ứng.
- Vế phải có 8 oxi, vế phải có 3 oxi.
- BSCNN của 3 và 8 là 24
=> Ghi 8 vào trước HNO3. Ta có : \ ( 8HNO _3 \ rightarrow 4H _2O \ rightarrow 2NO \ ) Phương trình hóa học sau khi được cân đối : \ ( 3C u + 8HNO _3 \ rightarrow 3C u ( NO_3 ) _2 + 2NO + 4H _2O \ )
4.5. Cân bằng theo phương pháp đại số
-
Dựa theo nguyên tắc: Số nguyên tử của các nguyên tử ở 2 vế phải bằng nhau.
Các bước làm :
- Bước 1 : Điền những thông số a, b, c, d, e, … vào trước những chất trong phản ứng.
Ví dụ : \ ( aFeS_2 + bO_2 \ rightarrow cFe_2O_3 + dSO_2 \ )
- Bước 2 : Dùng định luật bảo toàn khối lượng để cân đối nguyên tố và tạo ra 1 phương trình đại số.
Fe : a = 2 c S : 2 a = d O : 2 b = 3 c + 2 d. Giải hệ phương trình gồm 3 phương trình trên. Chọn c = 1 => a = 2, d = 4 và b = 11/2. Nhân những thông số với 2, ta được phương trình cân đối : \ ( 4F eS_2 + 11O _2 \ rightarrow 2F e_2O_3 + 8SO _2 \ )
II. Các công cụ cần dùng khi học môn Hóa học
1. Bảng tuần hoàn nguyên tố hóa học (Nguyên tố hóa học)

Bảng tuần hoàn nguyên tố hóa học
Bảng tuần hoàn nguyên tố hóa học (gọi tắt là Bảng tuần hoàn) là một bảng có liệt kê lại các nguyên tố hóa học, dựa theo số hiệu nguyên tử (chính là số proton trong hạt nhân), cấu hình e (electron) và các tính chất hóa học của chúng. Các nguyên tố trong bảng được sắp xếp theo chiều tăng dần số hiệu nguyên tử.
Một bảng tiêu chuẩn gồm những nguyên tố hóa học được xếp thành 7 dòng và 18 cột, 2 dòng kép riêng không liên quan gì đến nhau nằm dưới cùng bảng. Các hàng trong bảng sẽ được gọi là chu kì, còn cột sẽ được gọi là nhóm. Một số những nguyên tố sẽ có những tên gọi đặc biệt quan trọng : Halogen, khí hiếm. Tất cả những phiên bản của bảng tuần hoàn chỉ gồm có những nguyên tố hóa học, không gồm có hỗn hợp, hợp chất, … Bảng tuần hoàn nguyên tố hóa học rất đầy đủ và rõ nét nhất. Dãy hoạt động hóa học của sắt kẽm kim loại là dãy gồm có những sắt kẽm kim loại được sắp xếp theo theo thứ tự phụ thuộc vào vào năng lực tham gia phản ứng hóa học với chất khác ( còn gọi là mức độ phản ứng ) của những sắt kẽm kim loại. Đặc trưng của dãy :
- Mức độ hoạt động hóa học của sắt kẽm kim loại sẽ giảm dần từ trái sang phải
Dãy hoạt động hóa học của sắt kẽm kim loại khi mới học sẽ khiến những bạn rất khó nhớ. Để hoàn toàn có thể ghi nhớ nhanh dãy này, những bạn hoàn toàn có thể tìm hiểu thêm mẹo dưới đây :
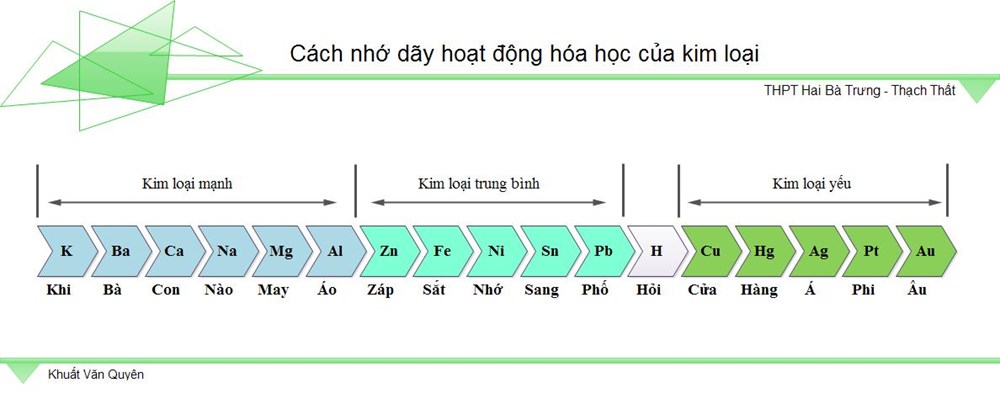
Mẹo nhớ Dãy hoạt động hóa học của sắt kẽm kim loại Hoặc Click vào link sau để hoàn toàn có thể điều tra và nghiên cứu dãy hoạt động hóa học được kĩ hơn : http://wp.ftn61.com/cong-cu-hoa-hoc/day-hoat-dong-kim-loai
3. Bảng tính tan hóa học
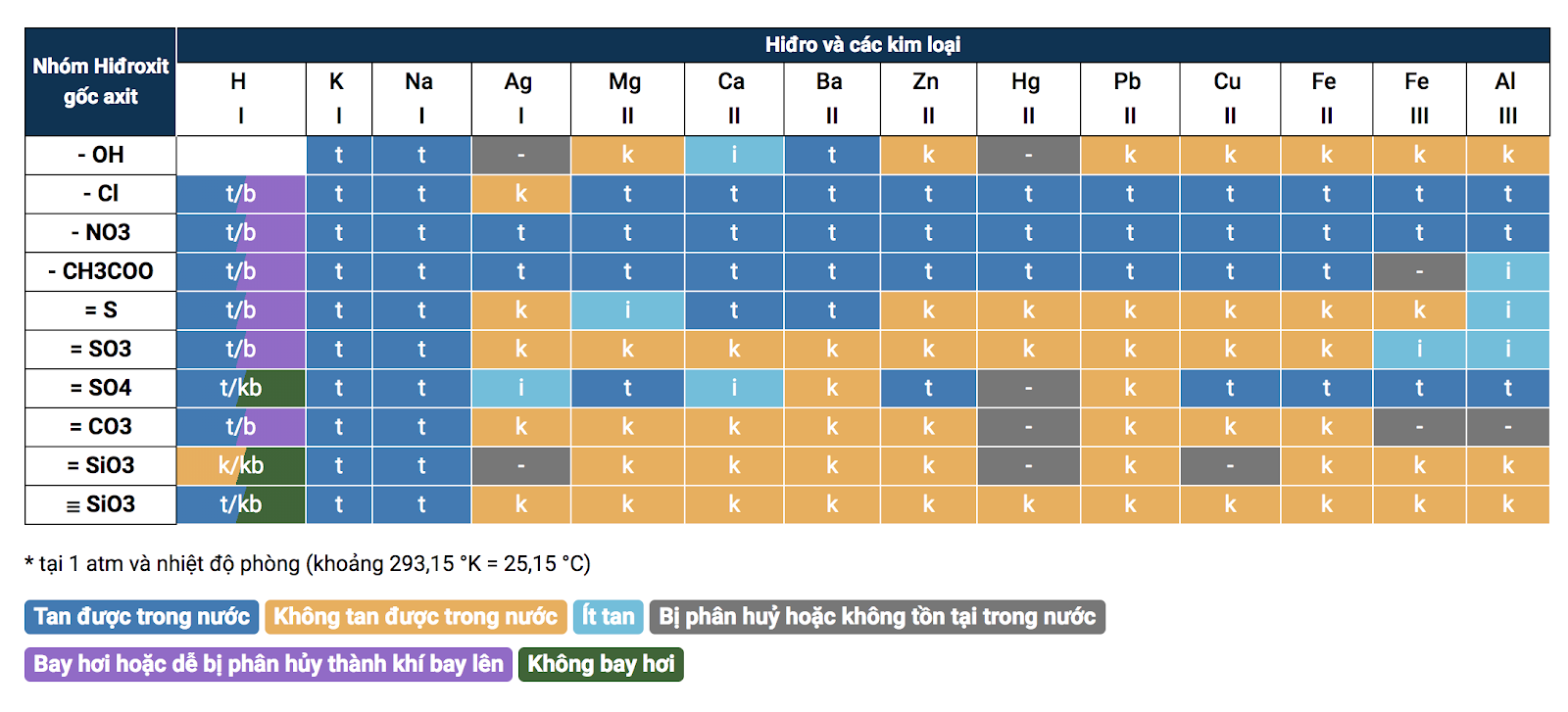
Bảng tính tan hóa học Bảng tính tan được dùng để phân biệt một chất có tan được trong nước hay không ( tan nhiều, tan ít, hay không tan ). Đây là một công cụ hữu dụng để những em học viên lấy địa thế căn cứ làm những bài tập dạng phân biệt những chất. Để xem Bảng tính tan cụ thể hơn, những bạn hãy Click Tại đây !
4. Dãy điện hóa của kim loại

Dãy điện hóa của sắt kẽm kim loại ( Xem không thiếu dãy điện hóa ) Dãy điện hóa của sắt kẽm kim loại sẽ cho ta biết những chất nào tính năng được với nhau dựa vào quy tắc Alpha. Kim loại đứng trước có tính khử mạnh hơn sắt kẽm kim loại đứng sau Kim loại đứng sau sẽ có tính oxi hóa mạnh hơn sắt kẽm kim loại đứng trước.
III. Những lưu ý trong chương trình Hóa học
1. Hóa học 8
Tại Nước Ta, bộ môn Hóa học được cho vào chương trình giảng dạy khởi đầu từ lớp 8. Các em sẽ khởi đầu được làm quen, được trình làng thế nào là chất ? Thế nào là nguyên tử ? Thế nào là nguyên tố, hóa trị, …. Ở lớp này, những em học viên phải rất là chú ý quan tâm học tập, để hoàn toàn có thể nắm rõ những kỹ năng và kiến thức cơ bản về bộ môn này, tránh thực trạng Mất gốc Hóa, gây khó khăn vất vả cho việc tăng trưởng của những em ở những lớp tiếp theo.

Phương trình hóa học 8 Muốn xem những phương trình hóa học được Open trong chương trình Hóa học 8, những em xem thêm tại đây : Tổng hợp những Phương trình hóa học lớp 8 khá đầy đủ nhất ! ( Xem thêm Giải bài tập Hóa học 8 )
2. Hóa học 9
Sau thời hạn làm quen với bộ môn Hóa lớp 8, những em cũng đã có một khối lượng kỹ năng và kiến thức về Hóa nhất định. Sang đến chương trình lớp 9, những em sẽ được tiếp cận kiến thức và kỹ năng về những chất hữu cơ ( gồm có những hidrocacbon và dẫn xuất của hidrocacbon ). Bên cạnh đó, những em sẽ được nâng cao kỹ năng và kiến thức về hợp chất vô cơ ( Oxit, axit, bazo và muối ), học những khái niệm về chất mới ( sắt kẽm kim loại, phi kim, … ) Đây sẽ là một năm học với những kỹ năng và kiến thức nặng hơn năm cũ. Các em hãy nỗ lực chuyên tâm để không bỏ lỡ bất kể kiến thức và kỹ năng Hóa học 9 có ích nào nhé ! Xem khá đầy đủ những Phương trình Hóa học lớp 9
Chi tiết Giải bài tập Hóa học 9
3. Hóa học 10
Tại chương trình Hóa học 10, những em sẽ được biết cấu trúc của 1 nguyên tử, thế nào là nguyên tố hóa học, làm quen với bảng tuần hoàn hóa học và nguyên tắc sắp xếp những nguyên tố trong bảng tuần hoàn, vận tốc phản ứng, cách cân đối phương trình hóa học, … Hãy cùng chú tâm để tiêu hóa hết lượng kiến thức và kỹ năng khủng của Hóa học 10 nhé ! Để giúp những em hoàn toàn có thể thuận tiện triển khai xong chương trình hóa học 10, Cunghocvui đã sưu tầm, tổng hợp lại những Phương trình hóa học lớp 10 khá đầy đủ nhất, Mời những em cùng xem tại Link : Tổng hợp Phương trình Hóa học 10
(Xem thêm chi tiết Giải bài tập Hóa học 10)
4. Hóa học 11
Chương trình Hóa học 11 sẽ đưa những em tiếp cận với những kiến thức và kỹ năng về Sự điện ly, khám phá những phi kim thuộc nhóm Nito, Cacbon, … và khởi đầu được học những chất hữu cơ.

Phương trình hóa học 11
Xem thêm: Tổng hợp Các phương trình Hóa học 11 đầy đủ nhất
Giải bài Tập Hóa học 11 chi tiết cụ thể
5. Hóa học 12
Ở lớp 12, Các em sẽ được học về những hợp chất hữu cơ : Este – Lipit, cacbonhidrat, amin, amino axit, polime và những vật tư polime. Bên cạnh đó, những em sẽ được học những kỹ năng và kiến thức mới về Hóa vô cơ, đồng thời ôn tập lại những kiến thức và kỹ năng Hóa từ những lớp dưới để sẵn sàng chuẩn bị cho kì thi tốt nghiệp trung học phổ thông cận kề. Hãy nỗ lực siêng năng dành thời hạn cho bộ môn này những em nhé ! Để hoàn toàn có thể học cũng như ôn luyện được tốt hơn, hãy Click vào Link sau : Phương trình Hóa học 12 – Nơi tổng hợp những phương trình hóa học hay được sử dụng nhất trong chương trình Lớp 12. ( Xem thêm cụ thể Giải bài tập Hóa học 11 ) Hóa học tưởng khó nhưng thực ra là rất dễ, nếu bạn đã hiểu thực chất của những yếu tố trong Hóa học. Hãy nỗ lực thuộc nằm lòng những công thức Hóa học, để mỗi khi cần, những bạn chỉ việc lôi ra và vận dụng. Nếu làm được điều đó, thì Hóa sẽ chẳng còn là khó tí nào nữa. Để giúp bạn, chúng tôi đã đi sưu tầm và tổng hợp lại được những Công thức Hóa học quan trọng và hay được sử dụng nhất. Rất mong nó sẽ là cuốn sổ tay học tốt giúp bạn vượt mặt mọi bài Hóa khó.
Click ngay để xem Tổng hợp Công thức Hóa học của Cunghocvui.
Phương trình hóa học của Chúng tôi rất tự hào khi được cùng bạn khám phá thế giới tri thức. Cảm ơn các bạn đã quan tâm và theo dõi!
Source: http://wp.ftn61.com
Category: Hỏi Đáp
Để lại một bình luận