Trước hết học viên cần ghi nhớ trình tự cân bằng một phương trình Hóa học :
Bước 1: cân bằng nhóm nguyên tử (OH, NO3, SO4, CO2, PO4..)
Bước 2: cân bằng nguyên tử Hidro
Bước 3: cân bằng nguyên tử Oxi
Bước 4: cân bằng các nguyên tố còn lại.
Tóm tắt nội dung bài viết
1. Phương pháp từ nguyên tố chung nhất
Có nghĩa là nguyên tố nào xuất hiện trong hầu hết những hợp chất trong phương trình cần cân bằng thì tất cả chúng ta sẽ chọn để cân bằng thông số những phân tử trước .
Vd : Cu + HNO3 -> Cu ( NO3 ) 2 + NO + H20
Trong phương trình này, nguyên tố Oxi Open nhiều nhất trong hầu hết những hợp chất nên sẽ cân bằng Oxi trước, rồi tới những nguyên tố khác .
Vế trái có 8 oxi, vế phải có 3 oxi. Vậy bội số chung nhỏ nhất của 8 và 3 là 24, suy ra thông số của HNO3 là 24/3 = 8
Vậy phản ứng cân bằng là : 3C u + 8HNO3 = 3C u ( NO3 ) 2 + 2NO + 4H2 O
2. Cân bằng theo trình tự Kim loại – Phi kim
Cân bằng phương trình hóa học nhanh theo chiêu thức này có nghĩa là cân bằng theo trình tự cân bằng số nguyên tử của sắt kẽm kim loại trước rồi tới phi kim, sau đó tới Hidro và tới oxi .
Vd : CuFeS2 + O2 -> CuO + Fe2O3 + SO2
Do nguyên tử Cu đã cân bằng nên thứ tự cân bằng tiên phong sẽ là : Fe sau đó sẽ là Cu, S, O rồi nhân đôi những thông số ta có tác dụng là :
4C uFeS2 + 13O2 = 4C uO + 2 Fe2O3 + 8SO2
3. Phương pháp dùng hệ số thập phân
Phương pháp này vận dụng như sau : đặt thông số vào những chất tham gia phản ứng, hoàn toàn có thể là số nguyên tố hoặc là phân số miễn sao cho số nguyên tử ở cả hai vế đều bằng nhau. Sau đó nhân lên để khử mẫu số chung ở 2 vế .
Vd: Fe + O2 -> Fe2O3
Trước tiên ta thêm thông số vào sẽ thành : 2F e + 3/2 O2 -> Fe2O3
Lúc này số nguyên tử ở 2 vế đã bằng nhau. Sau đó tất cả chúng ta nhân lên để khử mẫu, ở phương trình sẽ nhân lên cho 2 .
Kết quả là : 4F e + 3O2 = 2F e2O3
4. Phương pháp chẵn lẻ
Một trong những cách để cân bằng phương trình hóa học nhanh nữa là chiêu thức chẵn lẻ, được vận dụng như sau : Khi mà một phương trình phản ứng đã cân bằng có nghĩa là số nguyên tử của nguyên tố ở vế phải sẽ bằng với số nguyên tử của nguyên tố ở vế trái, đồng nghĩa là số nguyên tử của một nguyên tố ở vế trái chẵn thì số nguyên tử của nguyên tố đó ở vế phải cũng phải chẵn. Cho nên nếu trong phương trình mà nếu một trong số những số nguyên tử của bất kể nguyên tố nào còn lẻ thì phải nhân đôi .
Vd : Ta lấy lại ví dụ ở trên : Fe + O2 -> Fe2O3
Vế trái số nguyên tử của Fe lẻ còn bên phải thì chẵn nên ta nhân Fe ở vế trái lên 2. Còn oxi ở vế trái thì chẵn, vế phải thì lẻ, nên ta cũng nhân 2 cho số nguyên tử oxi ở vế phải .
2F e + O2 -> 2F e2O3
Đến đây số nguyên tử của cả 2 bên đều đã chẵn, ta chỉ việc cân bằng lại cho sô nguyên tử của 2 bên bằng nhau .
4F e + 3O2 = 2F e2O3
5. Phương pháp đại số
Học sinh đặt thông số a, b, c … lần lượt vào những công thức ở 2 vế của phương trình và thiết lập những phương trình toán học chứa những ẩn trên theo nguyên tắc số nguyên tử của nguyên tố trước và sau phản ứng bằng nhau. Bạn sẽ được 1 hệ phương trình chứa những ẩn, giải hệ phương trình này và đưa thông số tương ứng tìm dược vào phương trình phản ứng và khử mẫu ( nếu cần ) .
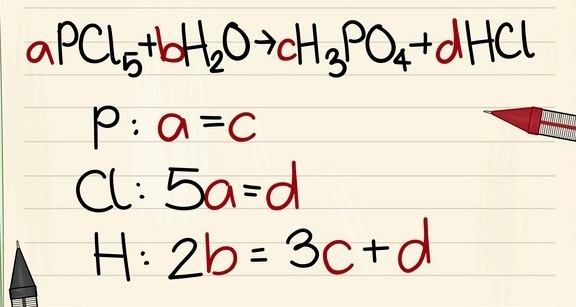
Với bài toán cân bằng phương trình hóa học FeS2 + O2 – > Fe2O3 + SO2, ta thấy, ở vế trái số nguyên tử O2 là chẵn với bất kể thông số nào trong khi đó vế phải, trong SO2 oxi là chẵn nhưng trong Fe2O3 là lẻ nên phải nhân đôi. Từ đó cân bằng tiếp những thông số còn lại. 2F e2O3 – > 4F eS2 – > 8SO2 + 11O2, thay vào PTPU ta được phương trình cân bằng là 4F eS2 + 11O2 = 2F e2O3 + 8SO2 .
Cân bằng phương trình Hóa Học ảnh hưởng trực tiếp tới kết quả của việc giải các bài tập. Bên cạnh 5 cách làm phổ biến trên, học sinh có thể sử dụng thêm phương pháp nguyên tử nguyên tố, phương pháp hóa trị tác dụng,…. Hi vọng rằng, những thông tin chia sẻ ở bài viết sẽ giúp các học sinh tự tin giải bài tập cân bằng phương trình Hóa Học chính xác hơn.
Tham khảo thêm:
♦ Phương pháp để nhớ lâu Bảng tuần hoàn Hóa học hiệu quả
♦ Góc học tập : Tìm hiểu môn Hóa qua những câu hỏi thực tiễn hay
Source: http://wp.ftn61.com
Category: Hỏi Đáp



Để lại một bình luận