Tóm tắt nội dung bài viết
Axit Nitric là gì ?
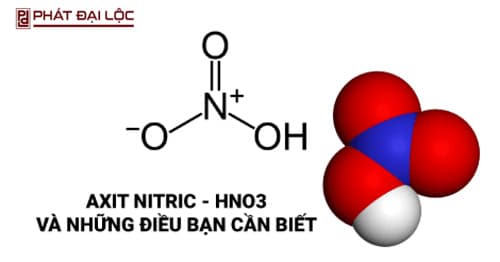 Axit nitric là một hợp chất thuộc loại vô cơ có công thức là HNO3. Axit nitric tinh khiết là chất lỏng không màu, bay hơi mạnh trong không khí ẩm.
Axit nitric là một hợp chất thuộc loại vô cơ có công thức là HNO3. Axit nitric tinh khiết là chất lỏng không màu, bay hơi mạnh trong không khí ẩm.
Axit nitric là một axit độc và ăn mòn, hoàn toàn có thể dễ cháy. Axit nitric nguyên chất không màu và chuyển màu sang màu hơi vàng do sự tích tụ của những oxit nitơ nếu để lâu .
Nếu một dung dịch chứa nhiều hơn 86% axit nitric, nó được gọi là axit nitric bốc khói. Hút axit nitric đậm đặc. Axit nitric bốc khói trắng và axit nitric bốc khói đỏ, tùy thuộc vào lượng nitơ đioxit có mặt.
Bạn đang đọc: Axit nitric (HNO3) là gì? Những lưu ý khi sử dụng
Tính lý của Axit Nitric
Tính chất vật lý
Axit nitric tinh khiết là chất lỏng không màu, bốc khói nhiều trong không khí ẩm, D = 1,53 g / cm3, sôi ở 860 độ C. Ngay cả ở điều kiện kèm theo thường, axit nitric tinh khiết không bền khi bị ánh sáng phân hủy, nếu nó bị hủy hoại một phần, khí nitơ đioxit ( NO2 ) được giải phóng .
Khí này tan trong dung dịch axit tạo cho dung dịch có màu vàng. Axit nitric là một chất lỏng không màu, hòa tan trong nước với mọi tỷ suất. Nó cũng có màu vàng nhạt trong thiên nhiên và môi trường tự nhiên do sự tích tụ của oxit nitơ .

Axit nitric nguyên chất có khối lượng riêng khoảng chừng 1522 kg / m3 khi tiếp xúc với không khí, khi axit nitric có nồng độ 86 % ta thấy có khói trắng .
Điểm đông là 42 ° C và điểm sôi là 83 ° C. Ở nhiệt độ cao, axit nitric hòa tan nitơ đioxit thành dung dịch có màu, vàng hoặc đỏ. Điều này ảnh hưởng tác động can đảm và mạnh mẽ đến những đặc thù vật lý phụ thuộc vào vào nồng độ NO2, đơn cử là áp suất hơi trên chất lỏng, điểm sôi và sắc tố của dung dịch .
Tính chất hóa học
Axit Nitric là một axit mạnh
Làm quỳ tím hóa đỏ. Tác dụng với oxit bazơ ( trong đó sắt kẽm kim loại đã đạt hóa trị cao nhất ) → muối + H2O :
2HNO3 + CuO → Cu ( NO3 ) 2 + H2O
Tác dụng với bazơ ( trong đó sắt kẽm kim loại đã đạt hóa trị cao nhất ) → muối + H2O :
2HNO3 + Mg ( OH ) 2 → Mg ( NO3 ) 2 + 2H2 O
Tác dụng với muối ( trong muối sắt kẽm kim loại đã đạt hóa trị cao nhất ) → muối mới + axit mới :
2HNO3 + CaCO3 → Ca ( NO3 ) 2 + CO2 + H2O
Tác dụng với sắt kẽm kim loại : HNO3 phản ứng với hầu hết những kim loại trừ Au và Pt → muối nitrat + H2 O và loại sản phẩm khử của N + 5 ( NO2, NO, N2O, N2 và NH4NO3 ) .
M + HNO3 → M ( NO3 ) n + H2O + NO2 ( NO, N2O, N2, NH4NO3 )
Tác dụng với phi kim → NO2 + H2O + oxit của phi kim .
C + 4HNO3 → CO2 + 4NO2 + 2H2 O
S + 4HNO3 → SO2 + 4NO2 + 2H2 O
P. + 5HNO3 → H3PO4 + 5NO2 + H2O
Tác dụng với những chất khử khác ( oxit bazơ, bazơ và muối trong đó sắt kẽm kim loại chưa có hóa trị cao nhất … ) .
4HNO3 + FeO → Fe ( NO3 ) 3 + NO2 + 2H2 O
4HNO3 + FeCO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
Chú ý : Nếu cho Fe hoặc hỗn hợp Fe và Cu tính năng với dung dịch HNO3 mà sau phản ứng còn dư sắt kẽm kim loại → trong dung dịch Fe thu được chỉ ở dạng muối Fe2 +. HNO3 đặc nguội thụ động với Al, Fe, Cr .
Sản xuất HNO3 ( Axit Nitric )
Trong phòng thí nghiệm
Trong thực tiễn, HNO3 kết tinh được phản ứng với axit sunfuric đặc, và hỗn hợp được chưng cất ở nhiệt độ sôi của axit nitric là 83 ° C cho đến khi vẫn còn chất kết tinh màu trắng .
Tuy nhiên, chiêu thức này chỉ tạo ra một lượng nhỏ axit. HNO3 được dùng làm thuốc thử tương quan đến clorit. Cho HNO3 phản ứng với mẫu thử, sau đó thêm dung dịch bạc nitrat vào để tìm kết tủa trắng của bạc clorua. Ngoài ra, nó còn được dùng để điều chế nitrat. Axit nitric bốc khói đỏ thu được trong thí nghiệm hoàn toàn có thể chuyển thành axit nitric trắng. Khi triển khai thí nghiệm, dụng cụ cũng cần phải làm bằng thủy tinh, đặc biệt quan trọng là bình cổ cong tích hợp axit nitric khan .
Cách điều chế HN03 trong phòng thí nghiệm
H2SO4d + NaNO3 → HNO3 + NaHSO4
Trong công nghiệp
HNO3 được sử dụng trong sản xuất thuốc nổ 68 % gồm có nitroglycerin, trinitrotoluen ( TNT ) và cyclotrimethylene trinitramine ( RDX ), cũng như amoni nitrat amoni nitrat NH4NO3 và những loại phân đạm khác, KNO3, Ca ( NO3 ) 2
Phải sử dụng axit nitric HNO3 trọn vẹn tinh khiết, vì một lượng nhỏ những ion sắt kẽm kim loại hoàn toàn có thể cản trở tác dụng nghiên cứu và phân tích. Vì axit nitric phản ứng với hầu hết những sắt kẽm kim loại trong những hợp chất hữu cơ nên nó được sử dụng trong luyện kim, mạ điện và tinh chế. Khi axit này được phối hợp với axit clorua, chúng tôi nhận được một dung dịch cường độ hoàn toàn có thể hòa tan bạch kim và vàng. Sử dụng axit nitric để sản xuất những chất hữu cơ, bột màu, sơn và thuốc nhuộm vải .
Được sử dụng như một thử nghiệm so màu để phân biệt heroin với morphin. Axit nitric được sử dụng trong sản xuất nitrobenzen, là tiền chất để sản xuất anilin và những dẫn xuất anilin, và có ứng dụng chính trong sản xuất bọt polyurethane, sợi aramid và thuốc .
Axit nitric cũng là chất trung gian để sản xuất bọt polyurethane linh động và những loại sản phẩm polyurethane khác, ví dụ điển hình như chất kết dính, chất bịt kín, chất phủ và chất đàn hồi, sử dụng toluen làm nguyên vật liệu thô, diisocyanate .
Dùng làm chất tẩy rửa đường ống và mặt phẳng sắt kẽm kim loại trong nhà máy sản xuất sữa. Axit nitric được sử dụng để vô hiệu tạp chất và cân đối lại tiêu chuẩn nước. Khi axit nitric loãng tạo thành hỗn hợp axit với 32 % nước, nó hoàn toàn có thể cô đặc đến 68 % axit .
Để thu được axit có nồng độ cao hơn, người ta dùng axit sunfuric H2SO4 để chưng cất. H2SO4 đóng vai trò là chất khử và sẽ tái hấp thu nước .
4NH3 + 5O2 → 4NO + 6H2 O ( Pt, 850 ∘ C )
2NO + O2 → NO2
4NO2 + O2 + 2H2 O → 4HNO3
Tác hại của Axit Nitric
Hít phải: ảnh hưởng xấu đến đường hô hấp, đặc biệt là tình trạng sưng phổi.
Nuốt phải: Gây bỏng miệng, họng, thực quản và dạ dày, nguy hiểm đến tính mạng. Nhẹ thì gây nôn mửa, tiêu chảy. Trong những trường hợp nghiêm trọng, rối loạn tuần hoàn với hậu quả tử vong có thể xảy ra. .
Tiếp xúc mắt: Tổn thương giác mạc, có thể dẫn đến mù lòa.
Tiếp xúc với da: Gây bỏng da. Tiếp xúc lâu có thể gây ung thư. Phải đeo thiết bị bảo hộ khi làm việc với axit nitric
Lưu ý khi sử dụng HNO3
Axit nitric là một chất oxy hóa mạnh, nếu phản ứng với xyanua, bột kim tuyến hoàn toàn có thể tiếng nổ và tự bốc cháy nếu phản ứng với nhựa thông .
Ở nồng độ cao, gây bỏng da do phản ứng với protein keratin, khiến da biến đổi màu sang vàng. Khi nó được trung hòa, nó chuyển sang màu cam.
Xem thêm: Làm Thế Nào Để Iphone 6 Chạy Nhanh Hơn
Có thể phản ứng mạnh với sắt kẽm kim loại và tạo thành khí hydro dễ cháy trong không khí. Khi pha loãng không được đổ nước vào axit, phải cho axit vào nước. Sử dụng hộp nhựa thay vì hộp sắt kẽm kim loại, vì axit nitric không phản ứng với vật tư này .
Các thùng chứa phải được đậy kín và tránh ánh sáng mặt trời. Khu vực dữ gìn và bảo vệ phải thoáng mát và tránh xa những nguồn nhiệt. Sàn phải chống axit .
Xem thêm : Nước javen là gì ? Cách điều chế nước javen
Source: http://wp.ftn61.com
Category: Thủ Thuật


Để lại một bình luận