Bạn đang đọc: Công thức Ancol
4.5 / 5 – ( 2 bầu chọn )





Tóm tắt nội dung bài viết
- ĐỊNH NGHĨA
- DANH PHÁP
- TÍNH CHẤT VẬT LÍ
- TÍNH CHẤT HOÁ HỌC
- ĐIỀU CHẾ
- BÀI TẬP SGK CB :
- BÀI TẬP BỔ SUNG :
- BÀI TẬP RÈN LUYỆN :
- Ancol
- Cấu trúc
- Phân loại
- Tính chất vật lý và hóa học
- Độc tính
- Sử dụng
- Sản xuất
- Các phương pháp chung cho ancol no đơn chức
- Một số phương pháp riêng
- Cách đặt tên
- Các dạng bài tập ancol và phương pháp giải bài tập
- Các dạng bài tập ancol
- Phương pháp giải bài tập
- Dạng 1: Viết đồng phân gọi tên ancol
- Dạng 2: Xác định CTPT của ancol
- Dạng 3: Ancol tách nước tạo Anken
- Dạng 4: Ancol tách nước trong điều kiện thích hợp
- Dạng 5: Ancol tách nước tạo Este
- Dạng 6: Phản ứng oxi hóa không hoàn toàn của ancol
- Xem thêm: Làm Thế Nào Để Iphone 6 Chạy Nhanh Hơn Dạng 7: Phản ứng oxi hóa hoàn toàn (phản ứng cháy)
ĐỊNH NGHĨA
– Ancol là những hợp chất hữu cơ trong phân tử có chứa nhóm – OH link với nguyên tử C no ( C sp3 ) của gốc hiđrocacbon .

– Ancol là mẫu sản phẩm thu được khi sửa chữa thay thế nguyên tử H link với C sp3 trong hiđrocacbon bằng nhóm – OH .
– Công thức tổng quát của ancol :
+ CxHyOz ( x, y, z thuộc N * ; y chẵn ; 4 ≤ y ≤ 2 x + 2 ; z ≤ x ) : thường dùng khi viết phản ứng cháy .
+ CxHy ( OH ) z hay R ( OH ) z : thường dùng khi viết phản ứng xảy ra ở nhóm OH .
+ CnH2n + 2-2 k – z ( OH ) z ( k = số link p + số vòng ; n, z là những số tự nhiên ; z ≤ n ) : thường dùng khi viết phản ứng cộng H2, cộng Br2, khi biết rõ số chức, no hay không no …
– Độ ancol là % thể tích của C2H5OH nguyên chất trong dung dịch C2H5OH
– Lần ancol là số nhóm OH có trong phân tử ancol .
– Bậc ancol là bậc của nguyên tử C link với nhóm OH .
DANH PHÁP
1. Tên thay thế
Tên thay thế sửa chữa = Tên hiđrocacbon tương ứng + số chỉ vị trí nhóm OH + ol
2. Tên thường
Tên thường = ancol ( rượu ) + Tên gốc hiđrocacbon + ic
Chú ý: Một số ancol có tên riêng cần nhớ:
CH2OH-CH2OH Etilenglicol
CH2OH-CHOH-CH2OH Glixerin ( Glixerol )
CH3-CH ( CH3 ) – CH2-CH2OH Ancol isoamylic




TÍNH CHẤT VẬT LÍ
1. Trạng thái
Từ C1 đến C12 là chất lỏng, từ C13 trở lên là chất rắn .
2. Nhiệt độ sôi
– So với những chất có M tương tự thì nhiệt độ sôi của : Muối > Axit > Ancol > Anđehit > Hiđrocacbon, ete và este …
– Giải thích : nhiệt độ sôi của một chất thường nhờ vào vào những yếu tố :
+ M : M càng lớn thì nhiệt độ sôi càng cao .
+ Độ phân cực của link : link ion > link cộng hóa trị có cực > link cộng hóa trị không cực .
+ Số link hiđro : càng nhiều link H thì nhiệt độ sôi càng cao .
+ Độ bền của link hiđro : link H càng bền thì nhiệt độ sôi càng cao .
3. Độ tan
– Ancol có 1, 2, 3 nguyên tử C trong phân tử tan vô hạn trong nước .
– Ancol có càng nhiều C, độ tan trong nước càng giảm vì tính kị nước của gốc hiđrocacbon tăng .
TÍNH CHẤT HOÁ HỌC
1. Phản ứng với kim loại kiềm
R ( OH ) z + zNa → R ( ONa ) z + z / 2H2
R ( ONa ) z : Natri ancolat rất dễ bị thủy phân trong nước :
R ( ONa ) z + zH2O → R ( OH ) z + zNaOH
Chú ý:
– Trong phản ứng của ancol với Na :
mbình Na tăng = mAncol – mH2 = nAncol. ( MR + 16 z ) .
mbình Ancol tăng = mNa – mH2 = nAncol. 22 z .
– Nếu cho dung dịch ancol phản ứng với Na thì ngoài phản ứng của ancol còn có phản ứng của H2O với Na .
– Số nhóm chức Ancol = 2. nH2 / nAncol .
2. Phản ứng với axit
a. Với axit vô cơ HX
CnH2n + 2-2 k – z ( OH ) z + ( z + k ) HX → CnH2n + 2 – zXz + k
→ số nguyên tử X bằng tổng số nhóm OH và số link pi .

b. Với axit hữu cơ (phản ứng este hóa)
ROH + R’COOH ↔ R’COOR + H2O
yR ( OH ) x + xR ’ ( COOH ) y ↔ R’x ( COO ) xyRy + xyH2O
Chú ý:
– Phản ứng được thực thi trong thiên nhiên và môi trường axit và đun nóng .
– Phản ứng có tính thuận nghịch nên quan tâm đến chuyển dời cân đối .
3. Phản ứng tách nước (đề hiđrat hóa)
a. Tách nước từ 1 phân tử ancol tạo anken của ancol no, đơn chức, mạch hở.
CnH2n + 1OH → CnH2n + H2O ( H2SO4 đặc, > 1700C )
Điều kiện của ancol tham gia phản ứng : ancol có Hα .
Chú ý:
– Nếu ancol no, đơn chức mạch hở không tách nước tạo anken thì Ancol đó không có Hα ( là CH3OH hoặc ancol mà nguyên tử C link với OH chỉ link với C bậc 3 khác ) .
– Nếu một ancol tách nước tạo ra hỗn hợp nhiều anken thì đó là ancol bậc cao ( bậc II, bậc III ) và mạch C không đối xứng qua C link với OH .
– Nhiều ancol tách nước tạo ra một anken thì xảy ra những năng lực sau :
+ Có ancol không tách nước .
+ Các ancol là đồng phân của nhau .
– Sản phẩm chính trong quy trình tách nước theo quy tắc Zaixep .
– Khi giải bài tập có tương quan đến phản ứng tách nước cần nhớ :
mAncol = manken + mH2O + mAncol dư
nancol phản ứng = nanken = nnước
– Các phản ứng tách nước đặc biệt quan trọng :
CH2OH-CH2OH → CH3CHO + H2O
CH2OH-CHOH-CH2OH → CH2 = CH-CHO + 2H2 O
b. Tách nước từ 2 phân tử ancol tạo ete
ROH + ROH → ROR + H2O ( H2SO4 đặc ; 1400C )
ROH + R’OH → ROR ’ + H2O ( H2SO4 đặc ; 1400C )
Chú ý:
– Từ n ancol khác nhau khi tách nước ta thu được n. ( n + 1 ) / 2 ete trong đó có n ete đối xứng .
– Nếu tách nước thu được những ete có số mol bằng nhau thì những ancol tham gia phản ứng cũng có số mol bằng nhau và nAncol = 2.nete = 2. nH2O và nAncol = mete + nH2O + mAncol dư .
4. Phản ứng oxi hóa
a. Oxi hóa hoàn toàn
CxHyOz + ( x + y / 4 – z / 2 ) O2 → xCO2 + y / 2H2 O
Chú ý:
– Phản ứng đốt cháy của ancol có đặc thù tương tự như phản ứng đốt cháy hiđrocacbon tương ứng .
+ Nếu đốt cháy ancol cho nH2O > nCO2 → ancol đem đốt cháy là ancol no và nAncol = nH2O – nCO2 .
+ Nếu đốt cháy ancol cho nH2O > 1,5. nCO2 → ancol là CH3OH. Chỉ có CH4 và CH3OH có đặc thù này ( không kể amin ) .
– Khi đốt cháy 1 hợp chất hữu cơ X thấy nH2O > nCO2 → chất đó là ankan, ancol no mạch hở hoặc ete no mạch hở ( cùng có công thức CnH2n + 2O x ) .
b. Oxi hóa không hoàn toàn (phản ứng với CuO hoặc O2 có xúc tác là Cu)
– Ancol bậc I + CuO tạo anđehit :
RCH2OH + CuO → RCHO + Cu + H2O
– Ancol bậc II + CuO tạo xeton :
RCHOHR ’ + CuO → RCOR ’ + Cu + H2O
– Ancol bậc III không bị oxi hóa bằng CuO .
Chú ý:
mchất rắn giảm = mCuO phản ứng – mCu tạo thành = 16. nAncol đơn chức .
5. Phản ứng riêng của một số loại ancol
– Ancol etylic CH3CH2OH :
C2H5OH + O2 → CH3COOH + H2O ( men giấm )
2C2 H5OH → CH2 = CH-CH = CH2 + 2H2 O + H2 ( Al2O3, ZnO, 4500C )
– Ancol không no có phản ứng như hidrocacbon tương ứng ví dụ : alylic CH2 = CH – CH2OH
CH2 = CH-CH2OH + H2 → CH3-CH2-CH2OH ( Ni, t0 )
CH2 = CH-CH2OH + Br2 → CH2Br-CHBr-CH2OH
3CH2 = CH-CH2OH + 2KM nO4 + 4H2 O → 3C3 H5 ( OH ) 3 + 2KOH + 2M nO2
– Ancol đa chức có những nhóm OH liền kề : tạo dung dịch màu xanh lam với Cu ( OH ) 2 ở nhiệt độ thường :
2R ( OH ) 2 + Cu ( OH ) 2 → [ R ( OH ) O ] 2C u + 2H2 O
– Một số trường hợp ancol không bền :
+ Ancol có nhóm OH link với C nối đôi chuyển vị thành anđehit hoặc xeton :
CH2 = CH-OH → CH3CHO
CH2 = COH-CH3 → CH3-CO-CH3
+ Ancol có 2 nhóm OH cùng gắn vào 1 nguyên tử C bị tách nước tạo anđehit hoặc xeton :
RCH ( OH ) 2 → RCHO + H 2O
HO-CO-OH → H2O + CO2
RC ( OH ) 2R ’ → RCOR ’ + H2O
+ Ancol có 3 nhóm OH cùng gắn vào 1 nguyên tử C bị tách nước tạo thành axit :
RC ( OH ) 3 → RCOOH + H2O
ĐIỀU CHẾ
1. Thủy phân dẫn xuất halogen
CnH2n + 2-2 k – xXx + xMOH → CnH2n + 2-2 k – x ( OH ) x + xMX
2. Cộng nước vào anken tạo ancol no, đơn chức, mạch hở
CnH2n + H2O → CnH2n + 1OH ( H + )
Phản ứng tuân theo quy tắc cộng Maccopnhicop nên nếu anken đối xứng thì phản ứng chỉ tạo thành 1 ancol .
3. Thủy phân este trong môi trường kiềm
RCOOR ’ + NaOH → RCOONa + R’OH
4. Cộng H2 vào anđehit hoặc xeton
RCHO + H2 → RCH2OH ( Ni, t0 )
RCOR ’ + H2 → RCHOHR ’ ( Ni, t0 )
5. Oxi hóa hợp chất có nối đôi bằng dung dịch KMnO4
3CH2 = CH 2 + 2KM nO4 + 4H2 O → 3CH2 OH – CH2OH + 2KOH + 2M nO2
6. Phương pháp riêng điều chế CH3OH
CH4 + H2O → CO + 3H2
CO + 2H2 → CH3OH ( ZnO, CrO3, 4000C, 200 atm )
2CH4 + O2 → 2 CH3OH ( Cu, 2000C, 100 atm )
7. Phương pháp điều chế C2H5OH
– Lên men tinh bột :
( C6H10O5 ) n → C6H12O6 → C2H5OH

Các phản ứng đơn cử :
( C6H10O5 ) n + nH2O → nC6H12O6
C6H12O6 → 2C2 H5OH + 2CO2 ( men rượu )
– Hidrat hóa etilen, xúc tác axit :
C2H4 + H2O → C2H5OH
Đây là những giải pháp điều chế ancol etylic trong công nghiệp .
VI. NHẬN BIẾT
– Tạo khí không màu với sắt kẽm kim loại kiềm ( chú ý quan tâm mọi dung dịch đều có phản ứng này ) .
– Làm CuO đun nóng từ màu đen chuyển thành Cu màu đỏ .
– Ancol đa chức có những nhóm OH liền kề hòa tan Cu ( OH ) 2 tạo dung dịch màu xanh .
– Ancol không no có phản ứng làm mất màu dung dịch Brom .














BÀI TẬP SGK CB :
BÀI 5 TRANG 187 CB:
Cho 12,20 g hỗn hợp X gồm etanol và propan – 1 – ol tính năng với natri dư thu được 2.80 lít khí ( đktc ) .
- Tính thành phần trăm Khối lượng của mỗi chất trong hỗn hợp X.
- Cho hỗn hợp X qua ống đựng CuO, đun nóng. Viết phương trình phản ứng .
GIẢI .
Phương trình phản ứng :
C2H5OH + Na — > C2H5ONa + ½ H2 ( a )
x mol
C3H7OH + Na — > C3H7ONa + ½ H2 ( b )
y mol
gọi x, y lần lượt là số mol etanol và propan – 1 – ol trong hỗn hợp X .
số mol khí H2 : n = V : 22,4 = 2,8 : 22,4 = 0,125 mol
Dựa vào phương trình phản ứng ( a ) và ( b ) :
x / 2 + y / 2 = 0,125 => x + y = 0,25 ( 1 )
Khối lượng hỗn hợp X :
46 x + 60 y = 12,2 ( 2 )
Từ ( 1 ) ( 2 ) giải hệ ta được : x = 0,2 mol ; y = 0,05 mol
Khối lượng của etanol : me = 0,2. 46 = 9,2 g
Khối lượng của propan – 1 – ol : mp = 0,05. 60 = 3 g
Xác Suất Khối lượng của etanol :
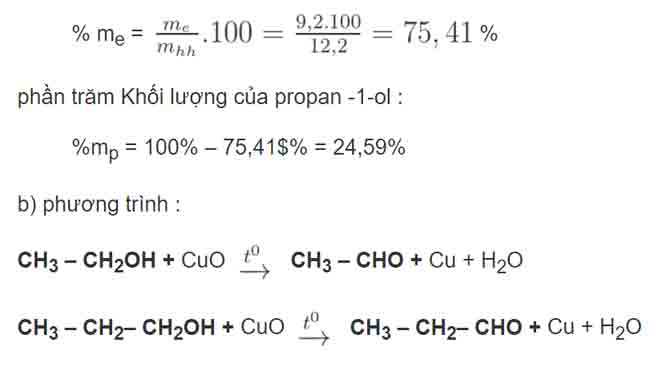
BÀI TẬP BỔ SUNG :
BÀI 1 :
Cho 6,9 g hỗn hợp ancol metylic và đồng đẳng A phản ứng với Na dư thu được 1.68 lít H2 ( đktc ) .
- Tính tổng số mol của 2 ancol trong hỗn hợp.
- Xác định cong thức phân tử của A biết số mol của 2 ancol trong hỗn hợp bằng nhau.
Giải.
1.Tính tổng số mol của 2 ancol
Gọi đồng đẳng A của ancol metylic là : CnH2n + 1 OH .
x, y lần lượt là số mol của ancol metylic và A .
phương trình phản ứng :
Xem thêm: Làm Thế Nào Để Iphone 6 Chạy Nhanh Hơn
CH3OH + Na — > CH3ONa + ½ H2 ( a )
x
CnH2n + 1 OH + Na — > CnH2n + 1 ONa + ½ H2 ( b )
y
số mol khí H2 : n = V : 22,4 = 1,68 : 22,4 = 0,075 mol
Dựa vào phương trình phản ứng ( a ) và ( b ) :
x / 2 + y / 2 = 0,075 => x + y = 0,15 ( 1 )
vậy : Tính tổng số mol của 2 ancol : x + y = 0,15 mol .
2.Xác định cong thức phân tử của A :
Theo đề bài : x = y
=> x = y = 0,15 : 2 = 0,075 mol .
Khối lượng của 2 ancol :
0,075. 32 + 0,075. ( 14 n + 18 ) = 6,9
=> n = 3
Vậy : A là C3H7 OH .
BÀI 2 :
Cho 25,8 g hỗn hợp ancol no đơn chức tiếp nối nhau trong dãy đồng đẳng phản ứng với Na dư thu được 5,6 lít H2 ( đktc ). Xác định cong thức phân tử của 2 ancol và tính khối lượng mỗi ancol .
Giải .
Gọi công thức của 2 ancol : CnH2n + 1 OH và CmH2m + 1 OH

Tính Khối lượng :
x, y lần lượt là số mol của C2H5 OH và C3H7 OH
Ta có :
Số mol hh : x + y = 0,5 mol
Khối lượng hh : x46 + y60 = 25,8
=> x = 0,3, y = 0,2
Khối lượng của C2H5 OH : 0,3. 46 = 13,8 g
Khối lượng của C3H7 OH : 0,2. 60 = 12 g .
BÀI TẬP RÈN LUYỆN :
BÀI 1 :
Cho 20,8 g hỗn hợp ancol metylic, ancol etylic và phenol chia làm hai phần bằng nhau .
- Phần 1 tác dụng natri dư thu được 2,62 lít H2 (270c và 750mmHg).
- Phần 2 phản ứng hết với 100ml dung dịch NaOH 1M.
- Viết phương trình phản ứng xảy ra (nếu có).
- Tính thành phần trăm Khối lượng các chất có trong hh đầu.
BÀI 2 :
Từ metan và những hóa chất thiết yếu. viết những phương trình điều chế :
- ancol metylic.
- ancol etylic
BÀI 3 :
Cho 38 gam 2 ancol nghiệm đơn chức A, B sau đó nhau trong dãy đồng đẳng công dụng natri dư thu được 8,4 lít H2 ( đktc ). Nếu đốt cháy cùng lượng hỗn hợp trên rồi cho hàng loạt loại sản phẩm qua nước vôi trong có dư thu được m gam kết tủa .
- Xác định CTPT và Khối lượng của A, B.
- Tính Khối lượng m gam kết tủa.
Ancol
Ancol, còn gọi là rượu, trong hóa học là một hợp chất hữu cơ chứa nhóm – OH gắn vào một nguyên tử cacbon mà đến lượt nó lại gắn với một nguyên tử hydro hay cacbon khác .
Trong đời sống thường thì, từ ancol được hiểu như thể những đồ uống có chứa cồn, ( cồn ( etanol ) hay ancol etylic ) ( C2H5OH ) .
Cấu trúc

Nhóm chức của ancol là nhóm hydroxyl – OH gắn với cacbon lai sp³. Còn gọi là nhóm chức ancol .
Phân loại
Theo cấu trúc
Có các loại ancol mạch thẳng và ancol mạch nhánh, vòng
Theo liên kết cacbon
Có các loại ancol no và ancol không no
Ví dụ: CH3-CH2-OH là ancol no và CH2=CH-CH2-OH là ancol không no.
Theo chức ancol
Có ancol đơn chức và ancol đa chức
Ví dụ: CH3-CH2-OH (etanol) là ancol một lần ancol còn OH-CH2-CH2-OH (etylen glycol) là ancol hai lần ancol.
Lưu ý là một số tài liệu cho rằng phenol C6H5OH là một dạng ancol, tuy nhiên phenol có một số tính chất hóa học khác hẳn tính chất hóa học chung của ancol và một số nhà khoa học đã xếp phenol và các dãy đồng đẳng của nó vào nhóm phenol do các chất này thể hiện tính axit rõ rệt. Ví dụ phenol có phản ứng với chất bazơ như NaOH còn ancol thì không có phản ứng như thế.
Tính chất vật lý và hóa học
Nhóm hydroxyl làm cho phân tử ancol phân cực. Nhóm này hoàn toàn có thể tạo ra những link hydro với nhau hoặc với chất khác. Hai xu thế hòa tan đối chọi nhau trong những ancol là : khuynh hướng của nhóm – OH phân cực tăng tính hòa tan trong nước và khuynh hướng của chuỗi cacbon ngăn cản điều này. Vì vậy, metanol, etanol và propanol dễ hòa tan trong nước vì nhóm hydroxyl chiếm lợi thế. Butanol hòa tan vừa phải trong nước do sự cân đối của hai xu thế. Pentanol và những butanol mạch nhánh phần đông không hòa tan trong nước do sự thắng thế của chuỗi cácbon. Vì lực link hóa học cao trong link của ancol nên chúng có nhiệt độ bốc cháy cao. Vì link hydro, ancol có nhiệt độ sôi cao hơn so với hiđrôcácbon và ête tương ứng. Mọi ancol đơn thuần đều hòa tan trong những dung môi hữu cơ .
Ancol còn được coi là những dung môi. Chúng hoàn toàn có thể mất proton H + trong nhóm hydroxyl và vì thế chúng có tính axit rất yếu : yếu hơn nước ( ngoại trừ metanol ), nhưng mạnh hơn amoniac ( NH4OH hay NH3 ) hay axetylen ( C2H2 ) .
C2H5-OH + Na → C2H5-ONa + H2 ↑
C2H5-ONa + HCl → C2H5-OH + NaCl
C2H5-ONa + H2O → C2H5-OH + NaOH
Một phản ứng hóa học quan trọng của ancol là phản ứng thế nucleophin ( nucleophilic substitution ), trong đó một nhóm nucleophin link với nguyên tử carbon được sửa chữa thay thế bởi một nhóm khác .
Ví dụ: CH3-Br + OH- → CH3OH + Br- (trong môi trường kiềm)
Đây là một trong các phương pháp tổng hợp ancol. Hay:
CH3-OH + Br- → CH3Br + OH- (trong môi trường axit)
ancol bản thân nó là những chất nucleophin, vì vậy chúng có thể phản ứng với nhau trong một số điều kiện nhất định về nhiệt độ, áp suất, môi trường v.v… để tạo thành ete và nước. Chúng cũng có thể phản ứng với các axit hydroxy (hay axit halogen) để sản xuất hợp chất este, trong đó este của các axit hữu cơ là quan trọng nhất. Với nhiệt độ cao và môi trường axit (ví dụ H2SO4), ancol có thể mất nước để tạo thành các alken. Ngược lại, việc thêm nước vào alken với xúc tác axit thì tạo thành ancol nhưng ít được sử dụng để tổng hợp ancol do tạo thành một hỗn hợp. Một số công nghệ kỹ thuật khác để chuyển alken thành ancol có độ tin cậy cao hơn.
Độc tính
Etanol
Các hình thức đồ uống chứa cồn được sử dụng từ rất lâu trong lịch sử loài người như hội hè, ăn kiêng, y tế, tôn giáo v.v… Việc sử dụng một lượng vừa phải etanol thì không có hại hoặc có thể có lợi cho cơ thể nhưng một lượng lớn ancol có thể dẫn đến tình trạng say ancol hay ngộ độc ancol cấp tính và các tình trạng nguy hiểm cho sức khỏe như: nôn, khó thở do thiếu oxy, lạnh, đột tử hoặc tình trạng nghiện ancol dẫn đến tổn thương gan, não nếu sử dụng thường xuyên.
Các loại ancol khác độc hơn etanol rất nhiều, một phần vì chúng tốn nhiều thời hạn hơn để phân hủy cũng như trong quy trình phân hủy chúng tạo ra nhiều chất độc cho khung hình. Metanol ( ancol gỗ ) được oxy hóa bởi những enzyme khử hydro trong gan tạo ra fomandehit ( formol ) hoàn toàn có thể gây mù hoặc tử trận .
Uống nhiều ancol rất có hại với sức khoẻ, người nghiện ancol hoàn toàn có thể mắc bệnh suy sinh dưỡng, giảm thị lực …
Metanol
Metanol rất độc, chỉ một lượng nhỏ xâm nhập vào cơ thể cũng có thể gây mù lòa, lượng lớn hơn có thể gây tử vong. Một điều thú vị là để ngăn chặn ngộ độc do dùng nhầm metanol thì người ta cho người bị ngộ độc dùng etanol. Etanol sẽ liên kết với các enzyme khử hydro và ngăn không cho metanol liên kết với các enzyme này
Sử dụng
Ancol có hiệu quả trong việc sản xuất đồ uống ( etanol ). Lưu ý là phần nhiều những loại ancol không hề sử dụng như đồ uống vì độc tính ( toxicity ) của nó hay làm nguồn nguyên vật liệu ( metanol ) hoặc dung môi hữu cơ cũng như nguyên vật liệu cho những mẫu sản phẩm khác trong công nghiệp ( nước hoa, xà phòng v.v … ) .
Metanol hầu hết được dùng để sản xuất Andehit Fomic nguyên vật liệu cho công nghiệp chất dẻo .
Etanol dùng để điều chế 1 số ít hợp chất hữu cơ như axit axetic, dietyl ete, etyl axetat … Do có năng lực hòa tan tốt 1 số ít hợp chất hữu cơ nên Etanol được dùng để pha vecni, dược phẩm, nước hoa … Trong đời sống hàng ngày Etanol được dùng để pha chế những loại đồ uống với độ ancol khác nhau .
Sản xuất
Phần lớn những loại ancol được sản xuất bằng phương pháp hóa học từ những chất hữu cơ sẵn có trong tự nhiên như dầu mỏ, hơi đốt hoặc than. Trong công nghiệp sản xuất đồ uống người ta sử dụng chiêu thức khác : lên men hoa quả hoặc ngũ cốc để tạo ra đồ uống có chứa cồn ( etanol ). Ngoài ra, trong phòng thí nghiệm, nếu chỉ cần một lượng nhỏ, ta có nhiều cách để tạo như :
Các phương pháp chung cho ancol no đơn chức
Hidrat hóa anken (cộng nước vào anken): Đun nóng anken với nước và chất xúc tác axit H2SO4, HCl, HBr, HClO4… Phản ứng theo cơ chế electrophin theo quy tắc Markovnikov (quy tắc Maccopnhicop).
CH2=CH2 + H2O → CH3-CH2OH (Xúc tác H+)
Thủy phân dẫn xuất halogen: Đun nóng Halogen trong dung dịch kiềm.
C2H5Br + NaOH → C2H5OH + NaBr
Đi từ andehit và xeton: Cộng hydro khi có xúc tác kim loại như Ni, Pt… cũng tạo thành ancol bậc I.
CH3CHO + H2 → CH3-CH2OH (Có xúc tác)
Phản ứng của amin bậc I với HNO2.
RNH2 + HNO2 → ROH + N2 +H2O
Một số phương pháp riêng
Lên men tạo etanol từ tinh bột hoặc xenlulozo
(C6H10O5)n + nH2O → nC6H12O6
C6H12O6 → 2C2H5OH + 2CO2
Tạo metanol: CO + 2H2 → CH3OH (300-400 °C và 250-300 at)
hoặc dùng: 2 CH4 + O2 → 2 CH3OH (200 °C, 100 at)
Thủy phân dầu mỡ động vật tạo glycerol.
Cách đặt tên
Hệ thống hóa tên gọi
Tên chung cho các loại ancol thường được lấy theo tên của ankyl và thêm từ ancol vào trước cộng với hậu tố íc vào sau. Ví dụ ancol metylíc và ancol êtylíc. Đối với các loại ancol phức tạp, tên gọi chung phụ thuộc vào vị trí của nhóm chức ancol trong mạch cácbon mà gọi là ancol bậc nhất, bậc hai hay bậc ba.
Trong mạng lưới hệ thống tên gọi của IUPAC, thì thêm hậu tố ol vào tên của ankan. Ví dụ metan – > metanol. Trong trường hợp thiết yếu thì vị trí của nhóm hydroxyl được thêm vào trước hoặc sau tên gọi. Ví dụ 1 – propanol hay propanol-1. Một cách đặt tên khác là thêm tiền tố hydroxy vào tên của ankan : 1 – hydroxypropan, 2 – hydroxypropan .
Ancol bậc ba thì thêm tiền tố 3 trước tên của ankyl + íc .
Ví dụ: (CH3)3COH là ancol 3-butylíc, hay 2-metyl 2-propanol theo quy tắc của IUPAC, chỉ ra rằng cả hai nhóm metyl và nhóm hydroxyl cùng gắn với nguyên tử ở giữa (thứ hai) của chuỗi propan.
Ancol với hai nhóm chức hydroxyl được gọi chung là “glycol”, ví dụ HO-CH2CH2-OH là êtylen glycol. Tên gọi của nó theo IUPAC là 1,2-etandiol, “diol” chỉ rằng có hai nhóm hydroxyl, và 1,2 chỉ vị trí liên kết của chúng. Các glycol tương tự (với cả hai nhóm hydroxyl liên kết với một nguyên tử cácbon), như 1,1-etandiol, nói chung là không ổn định. Đối với ancol có ba hoặc bốn nhóm chức ancol, sử dụng hậu tố “triol” and “tetraol”.


![]()













Các dạng bài tập ancol và phương pháp giải bài tập
Các dạng bài tập ancol
Dạng 1 : Viết đồng phân gọi tên ancol
Dạng 2 : Xác định CTPT của ancol
Dạng 3 : Ancol tách nước tạo Anken
Dạng 4 : Ancol tách nước trong điều kiện kèm theo thích hợp
Dạng 5 : Ancol tách nước tạo Este
Dạng 6 : Phản ứng oxi hóa không trọn vẹn của ancol
Dạng 7 : Phản ứng oxi hóa trọn vẹn ( phản ứng cháy )
Phương pháp giải bài tập
Dạng 1: Viết đồng phân gọi tên ancol
– Có 2 cách gọi tên ancol
+ Tên gốc – chức : “ Ancol ” + tên gốc hidrocacbon + “ ic ”
Ví dụ: CH3CH2OH là ancol etylic
+ Tên thay thế sửa chữa : Tên hidrocacbon + số chỉ vị trí nhóm OH + “ ol ”
Ví dụ: CH3CH2OH là etanol
– Các ancol có tên gọi thường thì thông dụng nhất là :
CH2OH-CH2OH: Etilen glicol
CH2OH-CHOH-CH2OH: Glixerol hoặc glixerin
Chú ý:
(CH3)2CH2– là gốc isopropyl
CH2=CH-CH2– là gốc anlyl
C6H5CH2– là gốc bezyl
Ví dụ: Gọi tên các ancol sau theo tên thông thường: C6H5CH2OH, CH2=CH-CH2OH, CH3CH2CH2OH
Trả lời :
C6H5CH2OH : Ancol benzylic
CH2 = CH-CH2OH : Ancol anlylic
CH3CH2CH2OH : Ancol propylic
Dạng 2: Xác định CTPT của ancol
– Từ công thức đơn thuần hoặc công thức thực nghiệm, ta suy luận dựa vào công thức tổng quát của ancol ( no đơn chức, không no đơn chức, đa chức … )
– Trong CTTQ : CxHyOz
Ta có : y = 2 x + 2 và y luôn chẵn .
– Trong ancol đa chức thì số nhóm OH > 1
Ví dụ 1: Cho Na phản ứng hoàn toàn với 18,8 gam hỗn hợp hai ancol kế tiếp nhau trong dãy đồng đẳng của ancol etylic, thu được 5,6 lít khí H2( ở đktc). Xác định CTPT của hai ancol?
Lời giải :

Ví dụ 2: Cho 15,6 gam hỗn hợp hai ancol đơn chức, kế tiếp nhau trong dãy đồng đẳng tác dụng hết với 9,2 gam Na, thu được 24,5 gam chất rắn. Xác định CTPT của hai ancol?
Lời giải :

Dạng 3: Ancol tách nước tạo Anken
+ Ancol tách nước tạo 1 anken duy nhất thì ancol đó là ancol no đơn chức, bậc 1
+ Áp dụng định luật bảo toàn khối lượng có : mancol = manken + mnước
+ nancol = nanken = nnước
+ Hỗn hợp X gồm 2 ancol tách nước thu được hỗn hợp Y gồm những olefin thì lượng CO2 thu được khi đốt cháy X bằng khi đốt cháy Y
Ví dụ 1: Tách nước hoàn toàn từ hỗn hợp X gồm 2 ancol A, B ta được hỗn hợp Y gồm các olefin. Nếu đốt cháy hoàn toàn hỗn hợp X thì thu được 1,76 g CO2. Khi đốt cháy hoàn toàn Y thì tổng khối lượng nước và CO2 tạo ra là?
Lời giải
Áp dụng định luật bảo toàn nguyên tố cacbon ta có
Lượng CO2 thu được khi đốt cháy Y bằng khi đốt cháy X = = 0,04 mol
Mà Y là hỗn hợp những olefin nên số mol H2O = số mol CO2 = 0,04 mol
Vậy tổng khối lượng CO2 và H2O thu được là : 0,04. 18 + 1,76 = 2,48 g
Ví dụ 2: Khi thực hiện phản ứng tách nước đối với ancol X, chỉ thu được 1 anken duy nhất. Oxi hoá hoàn toàn một lượng chất X thu được 5,6 lít CO2 (đktc) và 5,4 gam H2O. Có bao nhiêu công thức cấu tạo phù hợp với X?
Lời giải
X bị tách nước tạo 1 anken X là ancol no, đơn chức và chỉ có 1 hướng tách
Công thức phân tử của X là CnH2n + 1OH ;
Có nancol = nHO – nCO = 0,05 mol
Và n = 5. Nên công thức phân tử của X là C5H11OH
Công thức cấu trúc của X là
CH3 – CH2 – CH2 – CH2 – CH2OH
CH3 – CH ( CH3 ) – CH2 – CH2OH
CH3 – CH2 – CH ( CH3 ) – CH2OH
Dạng 4: Ancol tách nước trong điều kiện thích hợp
Phương pháp giải nhanh
Ancol X tách nước trong điều kiện kèm theo thích hợp tạo loại sản phẩm hữu cơ Y thì
+ Nếu tỉ khối của Y so với X nhỏ hơn 1 thì Y là anken và dY / X = 14 / ( 14 n + 18 )
+ Nếu tỉ khối của Y so với X lớn hơn 1 thì Y là ete và dY / X = ( 2R + 16 ) / ( R + 17 )
Ví dụ: Đun nóng một ancol đơn chức X với dung dịch H2SO4 đặc trong điều kiện
thích hợp sinh ra chất hữu cơ Y, tỉ khối của X so với Y là 1,6428. Công thức phân
tử của Y là
Lời giải
Vì dX / Y = 1,6428 nên dY / X = 1/1, 6428 < 1
Suy ra : Y là anken
![]()
dY / X = 14 n / ( 14 n + 18 ) = 1/1, 6428 => n = 2
Vậy công thức phân tử của X là C2H6O
Dạng 5: Ancol tách nước tạo Este
+ Hỗn hợp 2 ancol tách nước tạo 3 ete, 3 ancol tách nước tạo 6 ete
+ vận dụng định luật bảo toàn khối lượng có : mancol = manken + mnước
+ nete = nnước = nancol
+ Các ete có số mol bằng nhau thì những ancol cũng có số mol bằng nhau
+ Tổng số nguyên tử cacbon trong ancol bằng số nguyên tử trong ete
Ví dụ 1: Đun nóng hỗn hợp gồm 2 ancol đơn chức, mạch hở, kế tiếp nhau trong dãy đồng đẳng với H2SO4 đặc ở 140oC. Sau khi các phản ứng kết thúc, thu được 6 gam hỗn hợp 3 ete và 1,8 gam nước. Công thức phân tử của 2 ancol trên là?
Lời giải
Ta có nancol = 2 nnước = 2. = 0,2 mol
vận dụng định luật bảo toàn khối lượng có : mancol = mete + mnước = 6 + 1,8 = 7,8 gam
Gọi công thức chung của 2 ancol OH. Suy ra = = 39 = 39 – 17 = 22
Mà 2 ancol là đồng đẳng liên tục nên 2 ancol phải là CH3OH và C2H5OH
Ví dụ 2:Cho V lít (đktc) hỗn hợp khí gồm 2 olefin liên tiếp nhau trong dãy đồng đẳng hợp nước (xúc tác H2SO4 đặc), thu được 12,9 gam hỗn hợp A gồm 3 ancol. Đun nóng hỗn hợp A trong H2SO4 đặc ở 140oC thu được 10,65 gam hỗn hợp B gồm 6 ete khan. Công thức phân tử của 2 anken là?
Lời giải
Áp dụng định luật bảo toàn khối lượng ta có
mnước = mancol – mete = 12,9 – 10,65 = 2,25 gam ; nnước = = 0,125 mol
Ta có nancol = 2 nnước = 2. 0,125 = 0,25 mol. Gọi công thức chung của 2 ancol là OH
Suy ra = = 51,6 = 51,6 – 17 = 34,6. Mà 2 anken là đồng đẳng liên tục nên 3 ancol có 2 ancol là đồng phân của nhau và cũng là những ancol đồng đẳng liên tục. Nên 3 ancol là C2H5OH và C3H7OH 2 anken là C2H4 và C3H6 .
Dạng 6: Phản ứng oxi hóa không hoàn toàn của ancol
Khi đun nóng với CuO thì :
– Ancol bậc I bị oxi hóa thành anđehit .
– Ancol bậc II bị oxi hóa thành xeton .
– Ancol bậc III không bị oxi hóa .
Với ancol no, đơn chức mạch hở ta hoàn toàn có thể viết dưới dạng :
CnH2n + 2O + CuO → CnH2nO + Cu + H2O
Ví dụ 1: Cho m gam ancol no, đơn chức mạch hở X đi qua bình đựng CuO dư, nóng. Sau khi phản ứng xảy ra hoàn toàn, thấy có 1,6 gam CuO đã phản ứng. Hỗn hợp hơi Y sau phản ứng có tỷ khối so với H2 là 15,5. Xác định CTPT của X?
Lời giải

Ví dụ 2: Cho m gam một ancol no, đơn chức X qua bình CuO dư đun nóng. Sau khi phản ứng hoàn toàn, khối lượng chất rắn trong bình giảm 0,32 gam. Hỗn hợp hơi thu được có tỉ khối với hiđro là 15,5. Giá trị của m là
Lời giải
Áp dụng định luật bảo toàn khối lượng và nguyên tố ta có
nancol = nanđehit = = = 0,02 mol
Ta có sơ đồ : R – CH2OH + CuO → R – CHO + Cu + H2O
0,02 mol 0,02 mol 0,02 mol
Ta có : M = 15,5 x 2 = 31
Suy ra R = 15 nên ancol X là CH3OH
Vậy khối lượng ancol X là : m = 0,02. 32 = 0,64 gam .
Xem thêm: Làm Thế Nào Để Iphone 6 Chạy Nhanh Hơn
Dạng 7: Phản ứng oxi hóa hoàn toàn (phản ứng cháy)
Xem thêm: Làm Thế Nào Để Iphone 6 Chạy Nhanh Hơn
Phản ứng đốt cháy ancol :

Ví dụ 1: Đốt cháy hoàn toàn ancol X thu được hỗn hợp V lít(đktc) CO2 và 1,08 gam H2O. Dẫn toàn bộ lượng CO2 này vào 2 lít dung dịch NaOH 0,1M thu được dung dịch NaOH có nồng độ là 0,05M. Xác định công thức dãy đồng đẳng X, biết X là ancol đơn chức.
Lời giải

Source: http://wp.ftn61.com
Category: Thủ Thuật



Để lại một bình luận