Vậy cân bằng phương trình hóa học đối với phản ứng Oxi hóa – Khử bằng phương pháp thăng bằng electron dựa trên nguyên tắc nào? chúng ta cùng ôn lại trong bài viết này và giải các bài tập cân bằng phương trình hóa học, phản ứng oxi hóa khử bằng phương pháp thăng bằng electron để hiểu rõ hơn nội dung này.
Bạn đang đọc: Bài tập cân bằng phương trình Phản ứng Oxi hóa Khử – Hóa lớp 10 – Trường THPT Thành Phố Sóc Trăng
Bạn đang xem : Bài tập cân đối phương trình Phản ứng Oxi hóa Khử – Hóa lớp 10
I. Phương pháp thăng bằng electron
– Để cân đối phương trình phản ứng hóa học bằng giải pháp cân đối electron điều quan trọng số 1 là tất cả chúng ta phải xác lập được số oxi hóa của những nguyên tố tham gia phản ứng oxi hóa – khử. Dưới đây là những quy tắc xác lập số Oxi hóa của những nguyên tố tham gia phương trình phản ứng oxi hóa khử .
1. Quy tắc xác định số Oxi hóa trong phản ứng Oxi hóa khử.
● Quy tắc 1: Số oxi hóa của các nguyên tố trong đơn chất bằng 0.
● Quy tắc 2: Trong hầu hết các hợp chất :
– Số oxi hóa của H là +1 (trừ các hợp chất của H với kim loại như NaH, CaH2, thì H có số oxi hóa –1).
– Số oxi hóa của O là –2 (trừ một số trường hợp như H2O2, F2O, oxi có số oxi hóa lần lượt là : –1, +2).
● Quy tắc 3: Trong một phân tử, tổng đại số số oxi hóa của các nguyên tố bằng 0. Theo quy tắc này, ta có thể tìm được số oxi hóa của một nguyên tố nào đó trong phân tử nếu biết số oxi hóa của các nguyên tố còn lại.
● Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng đại số số oxi hóa của các nguyên tử trong ion đó bằng điện tích của nó.
> Chú ý:
– Để biểu diễn số oxi hóa thì viết dấu trước, số sau, còn để biểu diễn điện tích của ion thì viết số trước, dấu sau. Ví dụ: Số oxi hóa Fe+3 còn ion sắt (III) ghi Fe3+.
– Nếu điện tích là 1+ (hoặc 1–) có thể viết đơn giản là + (hoặc -) thì đối với số oxi hóa phải viết đầy đủ cả dấu và chữ (+1 hoặc –1).
– Trong hợp chất, số oxi hóa của sắt kẽm kim loại kiềm luôn là + 1, kiềm thổ luôn là + 2 và nhôm luôn là + 3 .

2. Phương pháp thăng bằng electron cân bằng phương trình phản ứng oxi hóa khử
– Để lập phương trình phản ứng oxi hoá – khử theo chiêu thức cân đối electron, ta thực thi những bước sau đây :
* Ví dụ 1: Lập PTHH của phản ứng P cháy trong O2 tạo thành P2O5 theo phương trình:
P + O2 → P2O5
• Bước 1: Xác định số oxi hoá của các nguyên tố trong phản ứng để tìm chất oxi hoá và chất khử.
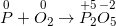
• Bước 2: Viết quá trình oxi hoá và quá trình khử, cân bằng mỗi quá trình.
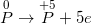
(quá trình oxi hoá)
( quy trình oxi hoá )
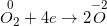
(quá trình khử)
( quy trình khử )
• Bước 3: Tìm hệ số thích hợp cho chất oxi hoá và chất khử, sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hoá nhận.
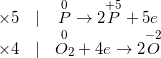
• Bước 4: Đặt các hệ số của chất oxi hoá và chất khử vào sơ đồ phản ứng, tính các hệ số của các chất khác, kiểm tra sự cân bằng của các nguyên tử của các nguyên tố ở hai vế,hoàn thành phương trình hoá học.
4P + 5O2 → 2P2 O5
* Ví dụ 2: Lập PTHH của cacbon monooxit khử sắt (III) oxit ở nhiệt độ cao, thành sắt và cacbon đioxit theo PTPƯ sau:
Fe2O3 + CO 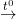
Fe + CO2
Fe + CO
• Bước 1: Xác định số oxi hoá
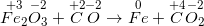
– Số oxi hoá của Fe giảm từ + 3 xuống 0 ⇒ Fe trong Fe2O3 là chất oxi hoá
– Số oxi hoá của C tăng từ + 2 lên + 4 ⇒ C trong CO là chất khử
• Bước 2: Viết quá trình oxi hoá và quá trình khử
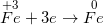
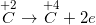
• Bước 3: Tìm hệ số thích hợp cho chất oxi hoá và chất khử
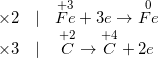
• Bước 4: Đặt các hệ số của chất oxi hoá và chất khử vào sơ đồ phản ứng, hoàn thành PTHH.
Fe2O3 + 3CO → 2F e + 3CO2
* Ví dụ 3: Cân bằng phương trình phản ứng Oxi hóa khử:
a ) Fe + HNO3 → Fe ( NO3 ) 2 + NO + H2O
b ) Fe + HNO3 → Fe ( NO3 ) 2 + NO2 + H2O
* Hướng dẫn:
a ) Fe + HNO3 → Fe ( NO3 ) 2 + NO + H2O
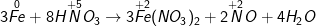

b ) Fe + HNO3 → Fe ( NO3 ) 2 + NO2 + H2O
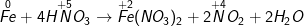

* Ví dụ 4: Cân bằng phương trình phản ứng Oxi hóa khử:
a ) Zn + HNO3 → Zn ( NO3 ) 2 + NO + H2O
b ) Zn + HNO3 → Zn ( NO3 ) 2 + NO2 + H2O
* Hướng dẫn:
a ) Zn + HNO3 → Zn ( NO3 ) 2 + NO + H2O
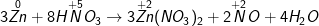

b ) Zn + HNO3 → Zn ( NO3 ) 2 + NO2 + H2O
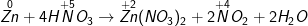

II. Bài tập cân bằng phương trình phản ứng Oxi hóa khử bằng phương pháp thăng bằng electron
> Lưu ý: Với phản ứng Oxi hóa khử, cần nhớ:
– Khử cho – O nhận
– Tên của chất và tên quy trình ngược nhau
– Chất khử là chất sẽ nhường electron ( hay cho e ) – đó quy trình oxi hóa .
– Chất oxi hóa là chất mà thu electron ( hay nhận e ) – đó là quy trình khử .
* Bài 1(Bài 7 trang 83 sgk hóa 10): Lập phương trình phản ứng oxi hóa – khử sau đây theo phương pháp thăng bằng electron:
a ) Cho MnO2 tính năng với dung dịch axit HCl đặc, thu được MnCl2, Cl2 và H2O .
b ) Cho Cu công dụng với dung dịch axit HNO3 đặc, nóng thu được Cu ( NO3 ) 2, NO2, H2O .
c ) Cho Mg công dụng với dung dịch axit H2SO4 đặc, nóng thu được MgSO4, S và H2O .
• Lời giải:
a) Ta có PTHH:
MnO2 + HCl đặc → MnCl2 + Cl2 ↑ + H2O
– Thực hiện những bước cân đối PTHH bằng giải pháp cân đối electron .
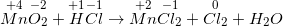
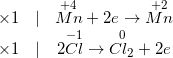
– Phương trình phản ứng được cân bằng như sau:
MnO2 + 4HC l đặc → MnCl2 + Cl2 ↑ + 2H2 O
b) Ta có PTHH:
Cu + HNO3 đặc, nóng → Cu ( NO3 ) 2 + NO2 ↑ + H2O
– Thực hiện cân đối bằng chiêu thức electron .
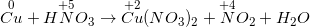
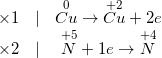
– Phương trình phản ứng được cân đối như sau :
Cu + 4HNO3 đặc, nóng → Cu ( NO3 ) 2 + 2NO2 ↑ + 2H2 O
c) Ta có PTHH:
Mg + H2SO4 đặc, nóng → MgSO4 + S ↓ + H2O
– Phương trình hoá học sau khi cân đối như sau :
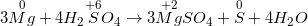
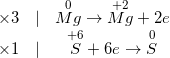
* Bài 2: Cân bằng các phản ứng oxi hóa khử sau:
a ) NH3 + O2 → NO + H2O
b ) Mg + HNO3 → Mg ( NO3 ) 2 + NH4NO3 + H2O
c ) Zn + H2SO4 → ZnSO4 + H2S + H2O
d ) MnO2 + HCl → MnCl2 + Cl2 + H2O
e ) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
f ) KMnO4 + FeSO4 + H2SO4 → Fe2 ( SO4 ) 3 + MnSO4 + K2SO4 + H2O
g ) KMnO4 + K2SO3 + H2O → K2SO4 + MnO2 + KOH
h ) FeO + HNO3 → Fe ( NO3 ) 3 + N2O + H2O
* Hướng dẫn:
a ) NH3 + O2 → NO + H2O
– Ta xác lập sự biến hóa số oxi hóa, và cân đối số electron
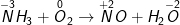

– Ta được phương trình sau khi cân đối như sau :
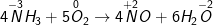
b ) Mg + HNO3 → Mg ( NO3 ) 2 + NH4NO3 + H2O
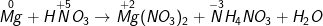

– Ta được phương trình sau khi cân đối như sau :

Bài 3: Cân bằng các phản ứng Oxi hóa – Khử sau:
a) KClO3 ![xrightarrow[]{t^0}](https://hayhochoi.vn/uploads/news/wyswyg/2020_11/1604815647ev6c0mjp6b_1604817601.gif)
KCl + O2
KCl + Ob ) AgNO3 Ag + NO2 + O2
Ag + NO + Oc ) Cu ( NO3 ) 2 CuO + NO2 + O2
CuO + NO + Od ) HNO3 NO2 + O2 + H2O
NO + O + He ) KMnO4 K2MnO4 + O2 + MnO2
MnO + O + MnO
• Lời giải:
a ) KClO3 KCl + O2
KCl + O
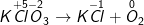

– Ta được: 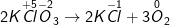
b ) AgNO3 Ag + NO2 + O2
Ag + NO + O
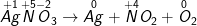

– Ta được: 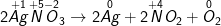
* Bài 4: Cân bằng các phản ứng oxi hóa khử sau:
a ) Cl2 + KOH → KCl + KClO3 + H2O
b ) S + NaOH → Na2S + Na2SO3 + H2O
c ) NH4NO2 → N2 + H2O
d ) I2 + H2O → HI + HIO3
* Bài 5: Cân bằng các phản ứng oxi hóa khử sau:
a ) Fe3O4 + HNO3 → Fe ( NO3 ) 3 + NO + H2O
b ) FeS2 + O2 → Fe2O3 + SO2
c ) FeS + KNO3 → KNO2 + Fe2O3 + SO3
d ) FeS2 + HNO3 → Fe ( NO3 ) 3 + H2SO4 + NO2 + H2O
e ) FeS2 + HNO3 + HCl → FeCl3 + H2SO4 + NO + H2O
f ) FeS + HNO3 → Fe ( NO3 ) 3 + Fe2 ( SO4 ) 3 + NO + H2O
g ) Cu2S + HNO3 → NO + Cu ( NO3 ) 2 + CuSO4 + H2O
h ) FeS + H2SO4 → Fe2 ( SO4 ) 3 + S + SO2 + H2O
* Bài 6: Cân bằng các phản ứng oxi hóa khử:
a ) M + HNO3 → M ( NO3 ) n + NO2 + H2O ( Với M là sắt kẽm kim loại hoá trị n )
– Thay NO2 lần lượt bằng : NO, N2O, N2, NH4NO3 rồi hoàn thành phản ứng .
b ) M + H2SO4 → M2 ( SO4 ) n + SO2 + H2O
c ) FexOy + HNO3 → Fe ( NO3 ) 3 + NO + H2O
– Thay NO lần lượt bằng NO2, N2O, N2, NH4NO3 rồi hoàn thành phản ứng .
d ) FexOy + H2SO4 → Fe2 ( SO4 ) 3 + SO2 + H2O
e ) FeO + HNO3 → Fe ( NO3 ) 3 + NxOy + H2O
Hy vọng với nội dung ôn tập về bài tập cân bằng phương trình phản ứng oxi hóa khử bằng phương pháp thăng bằng electron ở trên giúp các em rèn được kỹ năng giải các bài tập dạng này, điều đó sẽ giúp các em trong nhiều bài toán định lượng (bài tập tính toán cần viết phương trình phản ứng và thăng bằng với phương pháp electron).
Về cơ bản, để cân bằng phương trình phản ứng oxi hóa khử các em cần nhớ 3 bước chính, đó là: Xác định sự thay đổi số oxi hóa → lập thăng bằng electron → đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại. Chúc các em học tập tốt!
Đăng bởi : trung học phổ thông Sóc Trăng
Chuyên mục : Giáo Dục
Source: http://wp.ftn61.com
Category: Hỏi Đáp



Để lại một bình luận