Phương Trình Anilin Naoh, C6H5Nh2 + Hcl &Rarr C6H5Nh3Cl
Các Amin khác nhau bộc lộ đặc thù hoá học khác nhau, ví du như tính bazo của những Amin mạnh yếu khác nhau tuỳ vào vị trí của Nitơ gắn với gốc hidrocacbon đẩy e hay hút e, gốc không no hay gốc thơm .
Đang xem : Phương trình anilin naoh
Để hiểu rõ được tính chất hoá học, tính chất vật lý của các Amin chúng ta cùng tìm hiểu công thức cấu tạo của các Amin và vận dụng giải các bài tập về các amin qua bài viết dưới đây.
I. Amin – Định nghĩa, phân loại và danh pháp
1. Amin là gì?
– Amin là hợp chất hữu cơ được tạo ra khi thế một hoặc nhiều nguyên tử hiđro trong phân tử amoniac bằng một hoặc nhiều gốc hiđrocacbon .
Ví dụ: NH2 (amoniac) ; CH3-NH2 (metylamin) ; C6H5-NH2 (phenylamin) ; CH3-NH-CH3 (đimetylamin)
2. Phân loại Amin
– Amin được phân loại theo 2 cách thông dụng :
a) Theo đặc điểm cấu tạo của gốc hiđrocacbon
– Amin mạch hở : CH3NH2, C2H5NH2, …
– Amin mạch vòng : C6H5NH2, CH3C6H4NH2, …
b) Theo bậc của amin
– Bậc amin : là số nguyên tử H trong phân tử NH3 bị sửa chữa thay thế bởi gốc hiđrocacbon. Theo đó, những amin được phân loại thành : amin bậc 1, bậc 2, bậc 3 .
– Công thức cấu tạo (bậc) của amin:
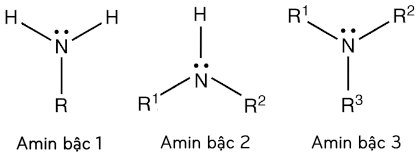
Ví dụ: CH3-CH2-CH2-NH2 (amin bậc 1) ; CH3-CH2-NH-CH3 (amin bậc 2) ; (CH3)3N (amin bậc 3).
– Công thức tổng quát của amin: CxHyNz (x, y, z ∈ N*; y ≤ 2x + 2 + z; y chẵn nếu z chẵn; y lẻ nếu z lẻ).
hoặc : CnH2n + 2-2 k + tNt ( n ∈ N * ; k ∈ N ; t ∈ N * ) .
3. Cách gọi tên Amin – Danh pháp
a) Cách gọi tên theo danh pháp gốc – chức:
Tên amin = Gốc hiđrocacbon + amin
b) Cách gọi tên theo danh pháp thay thế :
Tên amin = Tên của hiđrocacbon tương ứng + Số thứ tự của C chứa nhóm NH2 + amin
c) Tên thông thường chỉ áp dụng với một số amin: Ví dụ: anilin C6H5NH2
II. Tính chất vật lý của Amin
– Các amin có năng lực tan tốt trong nước, do giữa amin và nước có link Hiđro liên phân tử. Độ tan trong nước giảm khi số nguyên tử C tăng .
– Metyl –, đimetyl –, trimetyl – và etylaminlà những chất khí có mùi khai không dễ chịu, độc, dễ tan trong nước, những amin đồng đẳng cao hơn là chất lỏng hoặc rắn
– Anilin là chất lỏng, nhiệt độ sôi là 184 oC, không màu, rất độc, ít tan trong nước, tan trong ancol và benzen
III. Cấu tạo phân tử, so sánh lực bazo của các Amin
1. Cấu trúc phân tử của amoniac và các amin
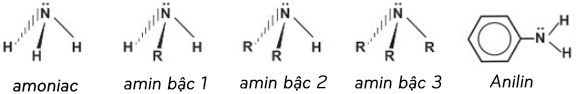
2. So sánh lực bazo giữa các amin
a) Các yếu tố ảnh hưởng đến lực bazơ của amin:
– Mật độ electron trên nguyên tử N : tỷ lệ càng cao, lực bazơ càng mạnh và ngược lại .
– Hiệu ứng khoảng trống : gốc R càng cồng kềnh và càng nhiều gốc R thì làm cho tính bazơ giảm đi, nhờ vào vào gốc hiđrocacbon .
Ví dụ: Tính bazơ của (CH3)2NH > CH3NH2 > (CH3)3N ; (C2H5)2NH > (C2H5)3N > C2H5NH2
b) Phương pháp so sánh lực bazo giữa các amin
– Gốc đẩy electron làm tăng tính bazơ, gốc hút electron làm giảm tính bazơ .
Ví dụ: p-NO2-C6H4NH2 6H5NH23 3NH2 2H5NH2 3H7NH2
– Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu. ( Rthơm ) 3N thơm ) 2NH thơmNH2 3 no NH2 no ) 2NH no ) 3N
– Nếu nguyên tử N trong phân tử amin gắn với những gốc hút e ( gốc không no, gốc thơm ) thì tính bazơ của amin yếu hơn so với tính bazơ của NH3. Những amin này không làm xanh quỳ tím .
– Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu .
IV. Tính chất hoá học của Amin
1. Tính bazơ của Amin
– Các phản ứng thể hiện tính bazơ
a) Amin tác dụng với dung dịch axit
CH3NH2 + H2SO4 → CH3NH3HSO4
2CH3 NH2 + H2SO4 → ( CH3NH3 ) 2SO4
CH3NH2 + CH3COOH → CH3NH3OOCCH3
b) Amin tác dụng với dung dịch muối tạo bazơ không tan
2CH3 NH2 + MgCl2 + 2H2 O → Mg ( OH ) 2 + 2CH3 NH3Cl
3. Phản ứng nhận biết bậc của amin
– Nếu là amin bậc I khi phản ứng với HNO2 tạo khí thoát ra :
RNH2 + HNO2 → ROH + N2 + H2O
– Anilin phản ứng tạo muối điazoni ở 0 → 50C :
C6H5NH2 + HNO2 → C6H5N2 + Cl – + 2H2 O
– Nếu là amin bậc II thì tạo hợp chất nitrozo màu vàng nổi trên mặt nước :
RNHR ’ + HNO2 → RN ( NO ) R ’ + H2O
– Amin bậc III không có phản ứng này .
4. Phản ứng nâng bậc amin
RNH2 + R’I → RNHR ’ + HI
RNHR ’ + R ’ ’ I → RNR’R ’ ’ + HI
5. Phản ứng riêng của Anilin
– Anilin là amin thơm nên không làm đổi màu quỳ tím thành xanh .
– Anilin tạo kết tủa trắng với dung dịch nước Brom :
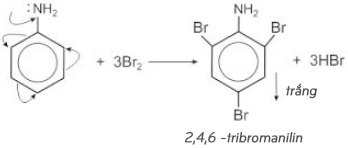
⇒ Phản ứng này được dùng để nhận ra anilin .
V. Điều chế Amin
1. Hiđro hóa hợp chất nitro
C6H5NO2 + 6H → C6H5NH2 + 2H2 O ( Fe / HCl )
2. Dùng kiềm mạnh đẩy amin ra khỏi muối amoni
C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O
⇒ Phản ứng này dùng để tách anilin ra khỏi hỗn hợp .
3. Thay thế nguyên tử H của NH3 (phản ứng nâng bậc)
NH3 + RI → R – NH2 + HI
VI. Bài tập về Amin
Bài 1 trang 44 SGK hoá 12: Có 3 hóa chất sau đây: Etylamin, phenylamin, amoniac. Thứ tự tăng dần tính bazơ được xếp theo dãy:
A. Amoniac * Lời giải Bài 1 trang 44 SGK hoá 12:
– Đáp án : C. Phenylamin 3 3 -, C2H5 -, iso propyl …
Các nhóm còn chứa cặp e chưa link : – OH ( còn 2 cặp ), – NH2 ( còn 1 cặp ) …
– Nhóm hút : tổng thể những nhóm có chứa link π, vì link π hút e rất mạnh .
– Những gốc hydrocacbon không no : CH2 = CH -, CH2 = CH-CH2 – …
– Những nhóm khác chứa nối đôi như : – COOH ( cacboxyl ), – CHO ( andehyt ), – CO – ( cacbonyl ), – NO2 ( nitro ), …
– Các nguyên tố có độ âm điện mạnh : – Cl, – Br, – F ( halogen ) …
Bài 2 trang 44 SGK hoá 12: Có thể nhận biết lọ đựng CH3NH2 bằng cách nào sau đây?
A. Nhận biết bằng mùi .
B. Thêm vài giọt dung dịch H2SO4 .
Xem thêm : Lổi Khi Cài Vntools Cho Excel 2010 Bị Lỗi # Name Ở Ô Thành Tiền Bằng Chữ
C. Thêm vài giọt dung dịch Na2CO3 .
D. Đưa đũa thủy tinh đã nhứng vào dung dịch HCl đậm đặc lên phía trên miệng lọ đựng dung dịch CH3NH2 .
* Lời giải Bài 2 trang 44 SGK hoá 12:
– Đáp án : D. Đưa đũa thủy tinh đã nhứng vào dung dịch HCl đậm đặc lên phía trên miệng lọ đựng dung dịch CH3NH2 .
– Khi cho CH3NH2 công dụng với dung dịch HCl đặc ta thấy xung quanh Open khói trắng. Dựa vào đó phân biệt được CH3NH2, PTPƯ như sau :
CH3NH2 + HCl → CH3NH3Cl ( khói trắng )
Bài 3 trang 44 SGK hoá 12: Viết công thức cấu tạo, gọi tên và chỉ rõ bậc từng amin có công thức phân tử sau:
a. C3H9N .
b. C7H9N. ( có chứa vòng benzen )
*Lời giải Bài 2 trang 44 SGK hoá 12:
a ) C3H9N .
– Amin bậc 1 :
CH3-CH2-CH2-NH2 : n-propylamin
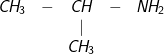
: iso propylamin
– Amin bậc 2 :
CH3-NH-CH2-CH3 : Etyl metylamin
– Amin bậc 3 :
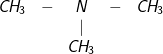
: Tri metylamin
b ) C7H9N. ( có chứa vòng benzen )
Amin bậc 1 :
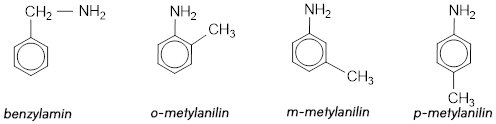
Amin bậc 2 :
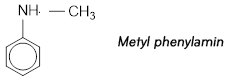
Bài 4 trang 44 SGK hoá 12: Trình bày phương pháp hóa học hãy tách riêng từng chát trong mỗi hỗn hợp sau đây ?
a. Hỗn hợp khí CH4 và CH3NH2 .
b. Hỗn hợp lỏng : C6H6, C6H5OH và C6H5NH2 .
* Lời giải Bài 4 trang 44 SGK hoá 12:
a ) Tách hỗn hợp khí CH4 và CH3NH2
– Cho hỗn hợp đi qua dung dịch HCl ta được CH3NH2 phản ứng với HCl bị giữ lại trong dung dịch, khí thoát ra ngoài là CH4 tinh khiết, ta có PTPƯ sau :
CH3NH2 + HCl → CH3NH2Cl
– Cho NaOH vào CH3NH2Cl thu lại được CH3NH2
CH3NH2Cl + NaOH → CH3NH2 + NaCl + H2O
b ) Tách hỗn hợp lỏng : C6H6, C6H5OH và C6H5NH2
– Cho dung dịch NaOH vào hỗn hợp lỏng trên thu được dung dịch gồm hai phần : phần 1 tan là C6H5OH tạo thành C6H5ONa và phần 2 hỗn hợp còn lại là C6H5NH2 và C6H6, ta có PTPƯ sau :
C6H5OH + NaOH → C6H5ONa + H2O
– Sục khí CO2 vào phần dung dịch tan ta thu lại được C6H5OH kết tủa .
C6H5ONa + CO2 + H2O → C6H5OH ↓ + NaHCO3
– Với hỗn hợp C6H5NH2 và C6H6 : cho công dụng dung dịch HCl, thu được dung dịch gồm hai phần : phần tan là C6H5NH3Cl, phần không tan là C6H6. Lọc phần không tan ⇒ tách được C6H6, ta có PTPƯ sau :
C6H5NH2 + HCl → C6H5NH3Cl
– Cho dung dịch NaOH vào phần dung dịch, ta thu lại được C6H5NH2 kết tủa theo PTPƯ :
C6H5NH3Cl + NaOH → C6H5NH2 ↓ + NaCl + H2O
Bài 5 trang 44 SGK hóa 12: Hãy tìm phương pháp hóa học để giải quyết hai vấn đề sau:
a. Rửa lọ đã đựng aniline
b. Khử mùi tanh của cá sau khi mổ để nấu. Biết rằng mùi tanh của cá, đặc biệt quan trọng là của những mè do hỗn hợp 1 số ít amin ( nhiều nhát là trimetylamin ) và 1 số ít tạp chất khác gây nên .
* Lời giải Bài 5 trang 44 SGK hóa 12:
a ) Rửa lọ đã đựng anilin .
– Cho vào lọ đựng anilin dung dịch HCl sau tráng bằng nước cất .
C6H5NH2 + HCl → C6H5NH3Cl
b ) Khử mùi tanh của cá, ta cho vào một chút ít dấm CH3COOH những amin sẽ tạo muối với CH3COOH nên không còn tanh nữa .
( CH3 ) 3N + CH3COOH → CH3COONH ( CH3 ) 3
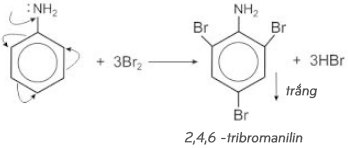
Bài 6 trang 44 SGK hóa 12: a) Tính thể tích nước brom 3% (D=1,3g/ml) cần để điều chế 4,4 gam tribromanilin.
b ) Tính khối lượng anilin có trong dung dịch A biết rằng khi cho tính năng vào nước brom thì thu được 6,6 gam kết tủa trắng. Giả sử hiệu suất của cả hai trường hợp là 100 % .
* Lời giải Bài 6 trang 44 SGK hóa 12:
– Phương trình phản ứng :
a ) theo bài ra, ta có : nC6H2Br3NH3 = m / M = 4,4 / 330 ( mol ) .
– Theo PTPƯ : nBr2 = 3. nC6H2Br3NH3 = ( 3.4,4 ) / 330 = 13,2 / 330 ( mol ) .
⇒ Khối lượng Br2 trong C6H2Br3NH3 là : mBr2 = ( 13,2. 160 ) / 330 = 6,4 ( g ) .
– Từ công thức : C % = ( mct / mdd ). 100 %
⇒ Khối lượng dung dịch Br2 ( 3 % ) là : mdd Br2 = ( mct ) / ( C % ) = ( 6,4 ) / ( 3 % ) = ( 6,4. 100 / 3 ) = 640 / 3 ( g ) .
⇒ Thể tích dung dịch Br2 cần dùng
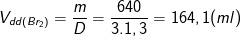
b ) C6H5NH2 + 3B r2 → C6H2Br3NH3 + 3HB r
⇒ số mol kết tủa là nC6H2Br3NH3 = 6,6 / 330 = 0,02 ( mol ) .
– Theo PTPƯ: nC6H5NH2) = nC6H2Br3NH3 = 0,02 (mol).
Xem thêm : hướng dẫn Đồ Án Tốt Nghiệp Xây Dựng Dân Dụng Rất Hay Và Chi Tiết
⇒ khối lượng aniline có trong dung dịch A là : mC6H5NH2 = n. M = 0,02. 93 = 1,86 ( g ) .
Xem thêm bài viết thuộc chuyên mục: Phương trình
Điều hướng bài viết
Source: http://wp.ftn61.com
Category: Hỏi Đáp



Để lại một bình luận