Axit Sunfuric là một cái tên quen thuộc đối với mọi người khi còn trong ghế nhà trường. Axit Sunfuric đã được mệnh danh là “Vua của các hóa chất” vì có vai trò cũng như là chất cần thiết, quan trọng trong nhiều ứng dụng đối với con người phục vụ đời sống. Bên cạnh đó Axit Sunfuric còn gây nhiều phiền toái và rất nguy hiểm nếu không sử dụng đúng cách. Hãy cùng mình tìm hiểu về chất này qua bài viết này nhé.
Tóm tắt nội dung bài viết
- Axit sunfuric là gì?
- Tính chất vật lí của H2SO4
- Tính chất hóa học của H2SO4
- Tính chất H2SO4 loãng
- Tính chất với H2SO4 đặc
- Sự phân cực và độ dẫn điện của H2SO4
- Những lưu ý về Axit Sunfuric (H2SO4):
- Những ứng dụng của H2SO4 mang lại cho con người
- Trong các ngành công nghiệp
- Xử lí chất thải
- Sản xuất phân bón
- Quá trình lọc dầu
- Áp dụng vào y học
- Sản xuất ắc quy chì
- Một số cách bảo quản Axit Sunfuric
- Điều chế Axit sunfuric như nào?
Axit sunfuric là gì?
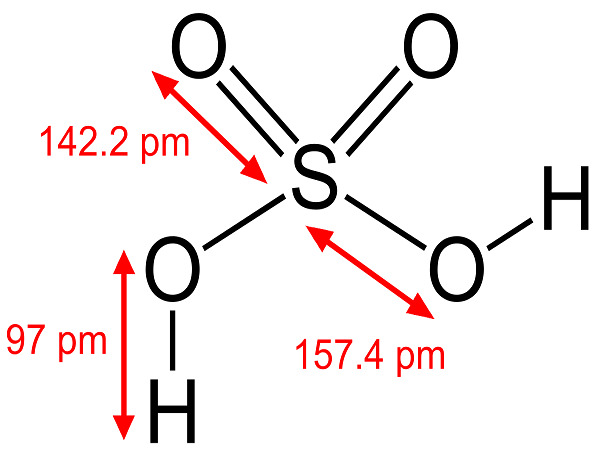
Axit sunfuric là một axit vô cơ phổ cập nhất, gồm những nguyên tố lưu huỳnh ( S ), oxy ( O ) và hydro ( H ). Công thức hóa học của nó là H2SO4. Nó có tên tiếng anh Acid Sulfuric, ngoài những còn có tên khác như là dầu Sulfate và Hydro sulfate .
Tính chất vật lí của H2SO4
Axit sunfuric là chất lỏng sánh như dầu. Nó không màu, không mùi và sánh, tan vô hạn trong nước. H2SO4 là chất rất háo nước, khi phản ứng xảy ra sẽ tỏa một lượng nhiệt cao. Tan nhiều trong hầu hết những dung môi hữu cơ. H2SO4 có năng lực làm than hóa những hợp chất hữu cơ .
Nhiệt độ sôi là 336 °C và Độ nóng chảy 10.371°C.
Tính chất hóa học của H2SO4
Axit Sunfuric có tính axit rất mạnh, tính bào mòn của chúng cũng đáng kể. Có thể gây nguy hại cho bất kỳ thứ gì mà nó chạm nào nếu vượt nồng độ được cho phép, hay nồng độ cao .
H2SO4 có độ dịch chuyển rất thấp nên đóng vai trò quan trọng trong việc điều chế những axit dễ bay hơi hơn từ những muối aixt khác. Ngoài ra hóa chất này được sử dụng để làm khô nhiều loại khí không phản ứng với axit vì tính háo nước của mình
Vì có tính axit, chúng cũng hoàn toàn có thể làm quỳ tím hóa đỏ .
Axit Sunfuric có hai loại : đặc và loãng
Tính chất H2SO4 loãng
- H2SO4 + kim loại (đứng trước H, trừ Pb) -> muối sunfat:
Fe + H2SO4 → FeSO4 + H2 ↑
- Tác dụng với oxit bazơ tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric + bazơ -> muối mới + nước
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2N aOH → Na2SO4 + 2H2 O
- H2SO4 + muối -> muối mới + axit mới
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2 ↑
H2SO4 + 2KHCO3 → K2SO4 + 2H2 O + 2CO2 ↑
Ở hai phương trình trên, axit mới là HCO3, vì đây là một axit yếu nên khi vừa sinh ra nó lại nhanh gọn trở thành H2O + CO2
Tính chất với H2SO4 đặc
- H2SO4 + kim loại -> muối sunfat + chất khử + nước
Ví dụ : Khi cho mảnh đồng ( Cu ) vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí mùi sốc thoát ra .
Cu + 2H2 SO4 → CuSO4 + SO2 ↑ + 2H2 O
- H2SO4 + phi kim -> oxit phi kim + nước, giải phóng khí SO2
C + 2H2 SO4 → CO2 + 2H2 O + 2SO2 ↑ ( nhiệt độ )
2P + 5H2 SO4 → 2H3 PO4 + 5SO2 ↑ + 2H2 O
- Ngoài ra, H2SO4 còn phản ứng với một số chất khử khác:
2F eO + 4H2 SO4 → Fe2 ( SO4 ) 3 + SO2 + 4H2 O
- Khi cho H2SO4 vào cốc đựng đường, đường sẽ dần có màu đen và phun trào:
C12H22O11 + H2SO4 → 12C + H2SO4. 11H2 O
Ngoài ra, nhiệt độ có trong H2SO4 cũng đóng vai trò quan trọng trong những phản ứng của nó. Ví dụ điển hình như, H2SO4 đặc nguội không có phản ứng với sắt ( Fe ) hay nhôm ( Al ), nhưng đặc nóng thì lại phản ứng .
Sự phân cực và độ dẫn điện của H2SO4
H2SO4 nguyên chất sẽ có thông số điện môi giao động 100, là một chất phân cực. Các phân tử của axit sunfutic có năng lực proton hóa lẫn nhau, tạo ra sự tính dẫn điện cực, quy trình này gọi là tự chuyển dời proton .
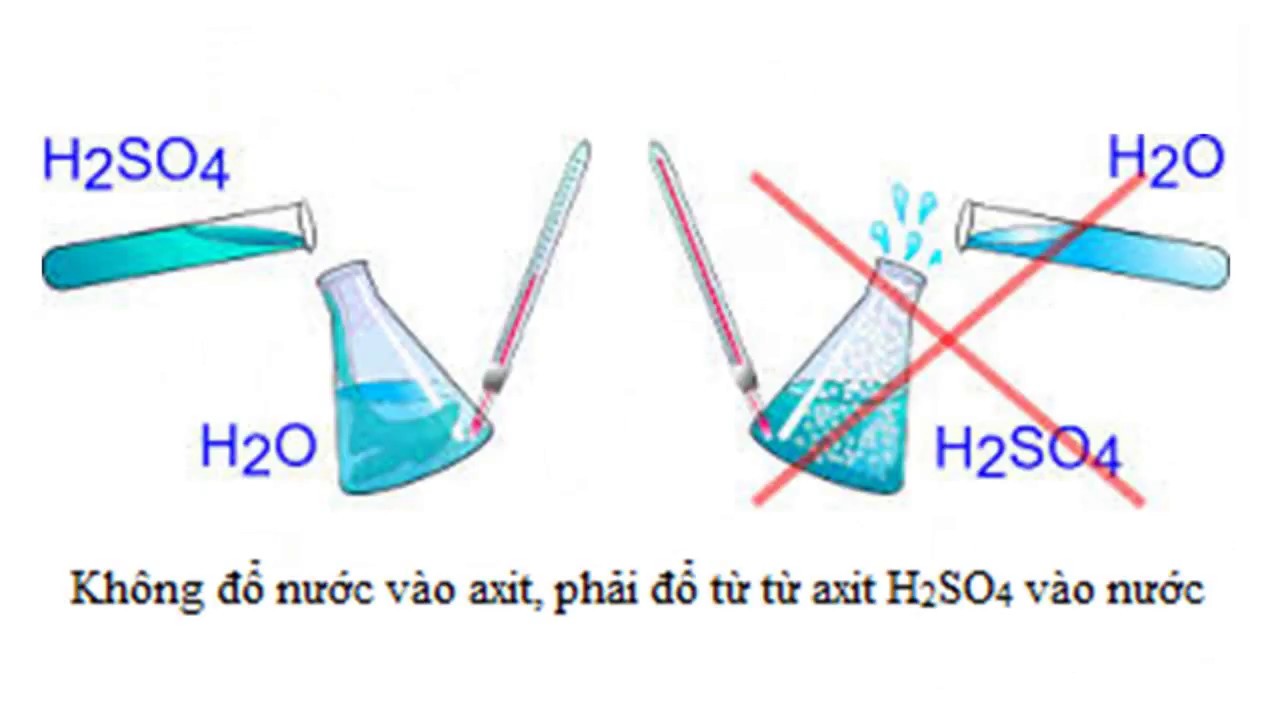
Những lưu ý về Axit Sunfuric (H2SO4):
Như những bạn đã biết, H2SO4 là một trong những axit vô cơ rất mạnh, nên tính bào mòn của chúng rất đáng kể. Khi để Axit Sunfuric với một nồng độ đáng kể ( thậm chí còn khi ở nồng độ đậm đặc 98 % ) hoàn toàn có thể gây bỏng nặng, bắn vào mắt hoàn toàn có thể mù, rơi vào giấy, vải sẽ bị cháy … Vì thế nên có sự chuẩn bị sẵn sàng kĩ càng trong khâu chế những phản ứng hóa học so với lọai axit này .
Với tính chất háo nước của mình, khi gặp nước H2SO4 sẽ phản ứng ngay lập tức và rất nhanh, bên cạnh đó còn tỏa một lượng nhiệt đáng kể. Chính vì lý do này, khi điều chế phản ứng này, chỉ được đổ từ từ H2SO4 vào trong nước, tuyệt đối không được làm ngược lại.
Điều này dễ hiểu khi ta đổ một lần lượng lớn sẽ gây tỏa nhiệt rất lớn hơn thông thường. Và nếu làm ngược lại, những hóa chất sẽ tung tóe và bắn ra ngoài, còn rủi ro tiềm ẩn gây nổ. Cả hai đều gây tổn thương, hoàn toàn có thể gây chết người ở xung quanh đó .
Đun sôi H2SO4 hoàn toàn có thể sản xuất ra khí SO2, SO3. Đây là hai khí gây độc và chết người .
Tuyệt đối không được để axit chảy vào hệ thống thoát nước. Không được ngửi hoặc hít hóa chất. Không được để axit tràn ra ngoài.
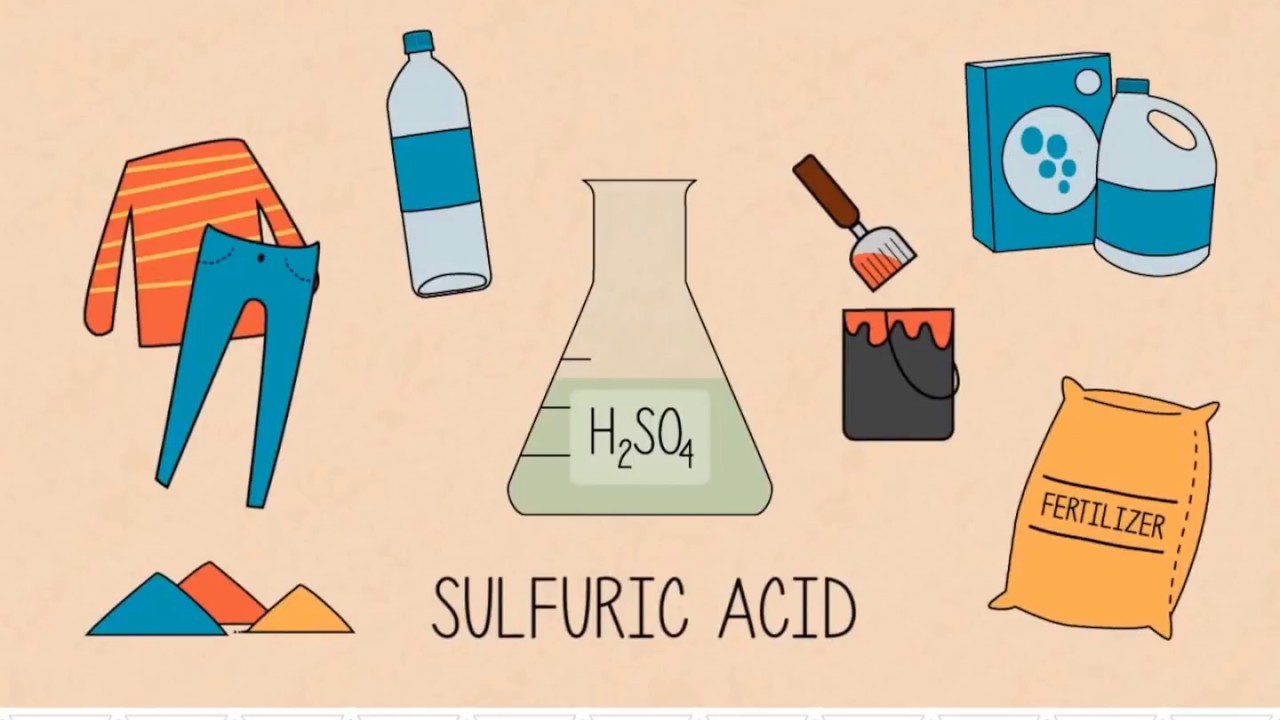
Những ứng dụng của H2SO4 mang lại cho con người
Dù rất có nhiều mối đe dọa, nguy khốn cho con người. Nhưng vẫn không hề phủ nhận việc những quyền lợi mà H2SO4 mang lại rất nhiều .
-
Trong các ngành công nghiệp
Axit sunfuric đóng vai trò trong hàng loạt những quy trình sản xuất sắt kẽm kim loại ( đồng, kẽm, … ) và là nguyên vật liệu của một số ít dung dịch dung dịch tẩy gỉ, làm sạch mặt phẳng thép, …
Sử dụng để sản xuất nhôm sunfat ( VD : phèn làm giấy ). Chất quan trọng trong quy trình sản xuất những loại muối sunfat, tẩy rửa sắt kẽm kim loại trước khi mạ, sản xuất thuốc nổ, chất dẻo, thuốc nhuộm, sản xuất dược phẩm, …
Hỗn hợp axit với nước còn được dung làm chất điện giải trong hàng loạt những dạng ắc quy, axit chì …
Ngoài ra còn xuất hiện trong những ngành công nghiệp như phân bón, luyện kim, phấn nhuộm, chết dẻo, giấy, sợi, …
-
Xử lí chất thải
Dùng để sản xuất nhôm hidroxit ( AlOH3 ), đây là chất được sử dụng để lọc những tạp chất, cải tổ mùi vị của nước, trung hòa độ pH của nước, và vô hiệu thực trạng nước cứng ( những ion Mg2 +, Ca2 + ) có trong nước thải .
-
Sản xuất phân bón
Dùng trong quy trình tạo ra axit photphoric – loại chất được sử dụng để sản xuất những loại phân photphat, hay Amoni sunfat .
-
Quá trình lọc dầu
Sử dụng một axit làm chất xúc tác phối hợp với H2SO4 thường được để vô hiệu những hợp chất của lưu huỳnh ( S ) và hydrocacbon không bão hòa có trong dầu thô. Một trong những chiêu thức lọc dầu khá thông dụng .
-
Áp dụng vào y học
Một trong những ứng dụng của H2SO4 trong y học chính là chế tạo hóa trị kìm hóa chống và ngăn ngừa ung thư .
-
Sản xuất ắc quy chì
Axit sunfuric khi ở dạng loãng được vận dụng để hoạt động giải trí như một chất điện phân để link những phần pin với nhau. Ở cách này H2SO4 được gọi là Pin axit .
Và nhiều ứng dụng khác …
Một số cách bảo quản Axit Sunfuric
Sử dụng bồn nhựa, phuy nhựa để chứa Axit Sunfuric. Tuyệt đối không dùng những bồn bằng nhôm, thiết, inox, kẽm, … Vì H2SO4 có đặc tính ăn mòn rất mạnh .
Nếu chứa H2SO4 bằng những bồn sắt đều phải bắt buộc tráng lớp PU. Đậy nắp kín, đặt nơi khô ráo. Tránh xa nơi có chứa những chất hoàn toàn có thể phản ứng với nó như bazơ hay những chất khử. Tránh để gần những sắt kẽm kim loại, sắt kẽm kim loại nhẹ, những chất có tính axit vì có năng lực gây nổ lớn .
Điều chế Axit sunfuric như nào?
Trước khi nói đến giải pháp điều chế Axit sunfuric. Tôi khuyên những bạn không nên tự tiện điều chế chúng, làm tại nhà .
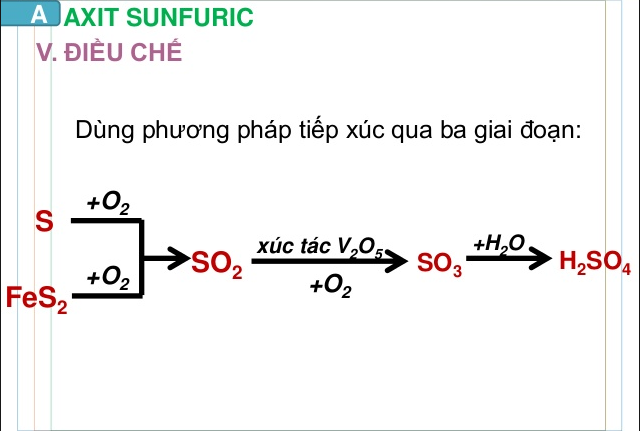
Có thể theo quy trình như sau : FeS2 hoặc S → SO2 → SO3 → H2SO4
– Đốt cháy quặng firit sắt :
4F eS2 + 11O2 → 8SO2 + 2F e2O3
– Oxi hóa SO2 bằng oxi trong điều kiện kèm theo 400 – 5000C, xúc tác V2O5 ) :
2SO2 + O2 → 8SO3
– Axit sunfuric đặc hấp thụ SO3 tạo thành oleum có công thức tổng quát là H2SO4. nSO3 :
nSO3 + H2SO4 → H2SO4. nSO3
– Pha loãng oleum thành axit sunfuric bằng lượng nước thích hợp :
H2SO4 .nSO3 + (n+1) H2O→ (n+1)H2SO4
Vậy tất cả chúng ta đã tìm hiểu và khám phá về H2SO4. Hi vọng qua bài viết trên, hoàn toàn có thể giúp những bạn hiểu được phần nào về Axit sunfuric .
Nguồn http://wp.ftn61.com/
Source: http://wp.ftn61.com
Category: Hỏi Đáp

Để lại một bình luận