Tóm tắt nội dung bài viết
- Câu hỏi : Điều chế HNO3 trong phòng thí nghiệm như thế nào ?
- Axit Nitric sở hữu tính chất vật lý nào?
- Axit Nitric sở hữu tính chất hóa học nào?
- Dung dịch HNO3 làm quỳ tím chuyển qua màu đỏ
- Tác dụng với nhiều kim loại ở nhiều nhóm (trừ Au, Pt)
- Tác dụng với phi kim (trừ Si, nhóm Halogen)
- Tác dụng với các bazơ, oxit bazơ, muối cacbonat
- Tác dụng với các hợp chất khác
- Điều chế HNO3 trong phòng thí nghiệm theo phương pháp nào?
- Các lưu ý khi thực hiện điều chế HNO3 trong phòng thí nghiệm
Câu hỏi : Điều chế HNO3 trong phòng thí nghiệm như thế nào ?
A. KNO3 và H2SO4đặc (Đáp án)
B. NaNO3 và HCl
C. NO2 và H2O
D. NaNO2 và H2SO4đ
Tìm hiểu cụ thể tại bài dưới đây :
Các loại axit là một trong những mắt xích cần thiết để xây dựng các phản ứng hóa học phục vụ trong cuộc sống, trong công nghiệp sản xuất. Một trong số axit hay được đề cập tới là Axit Nitric (HNO3). Việc điều chế HNO3 trong phòng thí nghiệm khá quan trọng, giúp chúng ta hiểu rõ hơn về hợp chất, ứng dụng tốt hơn trong việc xây dựng quy trình sản xuất công nghiệp.
Axit Nitric sở hữu tính chất vật lý nào?
Axit Nitric (HNO3) là dạng hợp chất hữu cơ tồn tại ở thể lỏng. Chất này không có màu, khi tiếp xúc với không khí ẩm thường bốc khói mạnh rồi chuyển sang hơi ngả vàng, khói này rất nguy hiểm cho con người. Sở dĩ dung dịch chuyển sang màu vàng là do trong đó đã bị tích tụ Nito Oxit bị oxi hóa ngoài không khí.
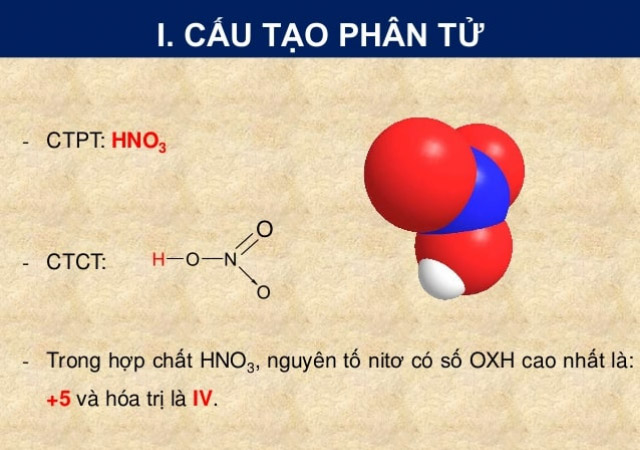 Phương trình : 4HNO3 → 4NO2 + 2H2 O + O2
Phương trình : 4HNO3 → 4NO2 + 2H2 O + O2
Nhiệt độ đông đặc của Axit Nitric ( HNO3 ) là : – 42 °C
Nhiệt độ sôi của Axit Nitric ( HNO3 ) là : 83 °C
Ở trong tự nhiên, Axit Nitric (HNO3) được sinh ra từ những tia sét, sấm chớp trước cơn mưa. Sau khi mưa, nếu lượng Axit Nitric (HNO3) lớn sẽ sinh ra các trận mưa axit thường thấy ở các nước châu Âu.
Axit Nitric (HNO3) vì thế được đánh giá là một axit mạnh, ở nồng độ nhẹ trong tự nhiên mà đã có tính ảnh hưởng lớn. Nếu ở nồng độ đậm đặc, tính sát thương và độ nguy hiểm của nó cực kỳ cao. Ở nồng độ trên 90%, Axit Nitric (HNO3) cực độc hại, ăn mòn rất nhiều chất và nếu không cẩn thận khi sử dụng có thể dẫn tới cháy nổ.
Axit Nitric sở hữu tính chất hóa học nào?
 Axit Nitric cơ bản thường sống sót dưới dạng dung dịch nitrat hydro. Công thức hóa học cơ bản là HNO3. Đánh giá cho thấy đây là một axit khan, có tính oxi hóa mạnh, nitrat hóa nhiều hợp chất vô cơ. Nhiều thí nghiệm đo hằng số cân đối hoàn toàn có thể thấy pKa = − 2. Khi điện li, nó phân li thành những ion nitrat NO3 −, H3O +. Một số đặc thù hóa học điển hình nổi bật của Axit Nitric ( HNO3 ) gồm :
Axit Nitric cơ bản thường sống sót dưới dạng dung dịch nitrat hydro. Công thức hóa học cơ bản là HNO3. Đánh giá cho thấy đây là một axit khan, có tính oxi hóa mạnh, nitrat hóa nhiều hợp chất vô cơ. Nhiều thí nghiệm đo hằng số cân đối hoàn toàn có thể thấy pKa = − 2. Khi điện li, nó phân li thành những ion nitrat NO3 −, H3O +. Một số đặc thù hóa học điển hình nổi bật của Axit Nitric ( HNO3 ) gồm :
Dung dịch HNO3 làm quỳ tím chuyển qua màu đỏ
Axit Nitric ( HNO3 ) là một axit nổi bật nên trọn vẹn hoàn toàn có thể làm cho giấy quỳ tím chuyển thành màu đỏ .
Tác dụng với nhiều kim loại ở nhiều nhóm (trừ Au, Pt)
Là một dạng hợp chất hữu cơ có tính oxi hóa cao nên dung dịch Axit Nitric ( HNO3 ) tính năng với hầu hết những sắt kẽm kim loại :
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( điều kiện kèm theo nhiệt độ )
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Mg ( rắn ) + 2HNO3 loãng lạnh → Mg ( NO3 ) 2 + H2 ( khí )
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Các sắt kẽm kim loại như Fe, Al, Cr thì bị thụ động hóa khi tính năng với dung dịch HNO3 đặc, nguội .
| | Xem thêm : Kim Loại Là Gì ? Tính Chất Hóa Học Chung Của Kim Loại
Tác dụng với phi kim (trừ Si, nhóm Halogen)
Axit Nitric (HNO3) có phản ứng với các phi kim sinh ra khí Nito Oxit và các loại khí khác.
C + 4HNO3 đặc nóng → CO2 + 4NO2 + 2H2 O
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2 O
Tác dụng với các bazơ, oxit bazơ, muối cacbonat
Axit Nitric ( HNO3 ) có công dụng với những bazơ, oxit bazơ, muối cacbonat để tạo thành muối nitrat và nước. Một số phản ứng hóa học khi tính năng bazo nổi bật :
2HNO3 + Mg ( OH ) 2 → Mg ( NO3 ) 2 + 2H2 O
2HNO3 + CaCO3 → Ca ( NO3 ) 2 + H2O + CO2
2HNO3 + CuO → Cu ( NO3 ) 2 + H2O
Tác dụng với các hợp chất khác
Axit HNO3 là axit mạnh, hoàn toàn có thể ăn mòn, hủy hoại nhiều hợp chất .
PbS + 8HNO3 ( đặc ) → PbSO4 ( kết tủa ) + 8NO2 + 4H2 O
3H2 S + 2HNO3 ( > 5 % ) → 3S ( kết tủa ) + 2NO + 4H2 O
Hợp chất Ag3PO4 tan trong HNO3 và HgS không công dụng với HNO3
Điều chế HNO3 trong phòng thí nghiệm theo phương pháp nào?
Cách điều chế HNO3 trong phòng thí nghiệm đã được xây dựng một cách cụ thể và bài bản, đưa vào giảng dạy trong các chương trình hóa học cấp phổ thông. Bằng cách cho
Axit Nitric hoàn toàn có thể điều chế bằng cách cho đồng ( II ) nitrat hoặc sử dụng phản ứng kali nitrat ( KNO3 ) với axit sunfuric ( H2SO4 ) 96 % với khối lượng bằng nhau. Chưng cất hỗn hợp ở nhiệt độ 83 °C và thu được chất kết tinh trắng kali hidrosunfat ( KHSO4 ), HNO3 sẽ bốc khói đỏ lên và dần chuyển thành axit màu trắng .
Phương trình điều chế HNO3 trong phòng thí nghiệm được mô tả tại phương trình:
H2SO4 + KNO3 → KHSO4 + HNO3
Hoặc có thể điều chế HNO3 trong phòng thí nghiệm bằng cách cho H2SO4 + NaNO3, phản ứng y hệt như với thí nghiệm trên.
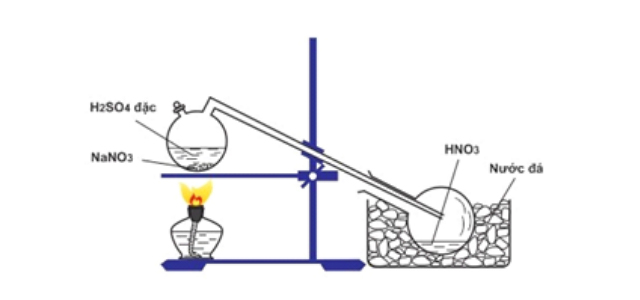
Các lưu ý khi thực hiện điều chế HNO3 trong phòng thí nghiệm
Axit Nitric ( HNO3 ) là một axit độc, dính vào da hoàn toàn có thể gây phỏng nặng và hoại tử. Vì thế trong quy trình điều chế và thí nghiệm với axit người thực thi phải cẩn trọng tối đa. Trang bị rất đầy đủ đồ bảo lãnh, triển khai đúng quy trình tiến độ. Ngoài ra những lọ đựng axit, những chất điều chế phải làm bằng thủy tinh, tốt nhất nên sử dụng bình cổ cong nguyên khối không nút, vì axit hoàn toàn có thể ăn mòn ngay cả nút luôn .
Dung dịch HNO3 ngoài điều chế bằng phương pháp trong phòng thí nghiệm thì còn được nghiên cứu điều chế dạng công nghiệp, phục vụ tối đa cho nhu cầu sử dụng. Công nghệ Ostwald do Wilhelm Ostwald phát minh giúp quá trình điều chế ra HNO3 nhanh chóng, đơn giản, tiết kiệm hơn.
| | Xem thêm : Phương Trình Điều Chế HCl Trong Phòng Thí Nghiệm
Với các thông tin cung cấp trên, bạn đọc đã nắm rõ được cách điều chế HNO3 trong phòng thí nghiệm hay chưa. Đây là một trong những loại axit điển hình, được đưa vào sách giáo khoa Hóa phổ thông. Hãy nắm kỹ nó để học tốt hơn bộ môn Hóa bạn nhé.
| | Bài viết tương quan khác :
Source: http://wp.ftn61.com
Category: Hỏi Đáp



Để lại một bình luận