Tóm tắt nội dung bài viết
- Câu hỏi : Điều chế SO2 trong phòng thí nghiệm như thế nào ?
- Lưu huỳnh đioxit (SO2) là gì?
- Tính chất hóa học của khí lưu huỳnh đioxit (SO2)
- Tác dụng với nước cất tạo ra một axit yếu:
- Tác dụng với một số dung dịch bazơ tạo ra muối:
- Vừa có phản ứng khử vừa có phản ứng oxi hóa:
- Phương pháp điều chế so2 trong phòng thí nghiệm
- Các ứng dụng của khí SO2 trong các lĩnh vực sản xuất
Câu hỏi : Điều chế SO2 trong phòng thí nghiệm như thế nào ?
Lời giải :
– Trong phòng thí nghiệm, SO2 được điều chế bằng cách cho muối sunfit công dụng với axit mạnh như HCl, H2SO4 .
Ví dụ :
Na2SO3 + 2HCl → 2NaCl + H2O + SO2
Bạn đang đọc: Điều Chế SO2 Trong Phòng Thí Nghiệm | Sơ đồ, phản ứng
– Ngoài ra, khí SO2 còn được điều chế bằng cách cho Cu tính năng với H2SO4 đặc .
Cu + 2H2 SO2đặc → CuSO4 + SO2 + 2H2 O
Khí SO2 được thu bằng giải pháp đẩy không khí .
SO2 là loại khí xuất hiện phổ biến trong cuộc sống của chúng ta. Việc nghiên cứu, giảm tác hại của nó trong bầu khí quyển, sản xuất và sử dụng vào các mục đích công nghiệp thực sự cần thiết. Bạn có biết cách điều chế SO2 trong phòng thí nghiệm, công nghiệp được thực hiện như thế nào hay không?
Lưu huỳnh đioxit (SO2) là gì?
Lưu huỳnh đioxit (SO2) là một hợp chất hóa học vô cơ. Ở bình thường nó ở thể khí, không có màu, nặng hơn không khí nhiều. Chúng ta có thể thu được khí lưu huỳnh đioxit (SO2) bằng cách đốt lưu huỳnh. Khi đốt lưu huỳnh, khí SO2 sinh ra chúng ta sẽ cảm thấy một mùi hôi khó chịu bốc lên.
- Các tên gọi khác của khí SO2 : sulfur đioxit, anhidrit sunfurơ, lưu huỳnh oxit .
- Một số đặc thù vật lý đơn cử của loại khí này :
- So2 có tan trong nước
- Độ hòa tan trong nước là : 9,4 g / 100 ml ( ở nhiệt độ phòng 25 oC )
- Khối lượng riêng là : 2,551 g / l
- Điểm nóng chảy là : – 72,4 * C ( 200.75 K )
- Điểm sôi là : – 10 * C ( 263 K )
Chúng ta hoàn toàn có thể thấy khí SO2 trong thực tiễn đời sống, ở tự nhiên nó là loại sản phẩm của những vụ núi lửa phun trào, những hợp chất sinh học có chứa lưu huỳnh. Ở những hoạt động giải trí của những xí nghiệp sản xuất, khu công nghiệp, khu lọc dầu, đốt than, sản xuất xi-măng, luyện kim, khói thải xe cộ, đốt rơm rạ ngoài đồng, …

Tính chất hóa học của khí lưu huỳnh đioxit (SO2)
Lưu huỳnh đioxit ( SO2 ) là một chất có tính oxi hóa, khi oxi hóa chậm trong không khí sẽ chuyển thành SO3. Chất xúc tác cho phản ứng này chính là quy trình quang hóa. Ngoài ra, một số ít đặc thù hóa học đơn cử của SO2 gồm :
Tác dụng với nước cất tạo ra một axit yếu:
Phương trình : SO2 + H2O → H2SO3
Tác dụng với một số dung dịch bazơ tạo ra muối:
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Vừa có phản ứng khử vừa có phản ứng oxi hóa:
SO2 biểu lộ tính khử qua những phản ứng sau :
2SO2 + O2 → 2SO3 ( V2O5, 450 oC )
Cl2 + SO2 + 2H2 O → H2SO4 + 2HC l
SO2 làm mất màu nước Brom : SO2 + Br2 + 2H2 O → 2HB r + H2SO4
SO2 làm mất màu thuốc tím : 5SO2 + 2KM nO4 + 2H2 O → K2SO4 + 2M nSO4 + 2H2 SO4
O2 bộc lộ tính oxy hóa qua những phản ứng sau :
SO2 + 2H2 S → 3S + 2H2 O
SO2 + 2M g → S + 2M gO
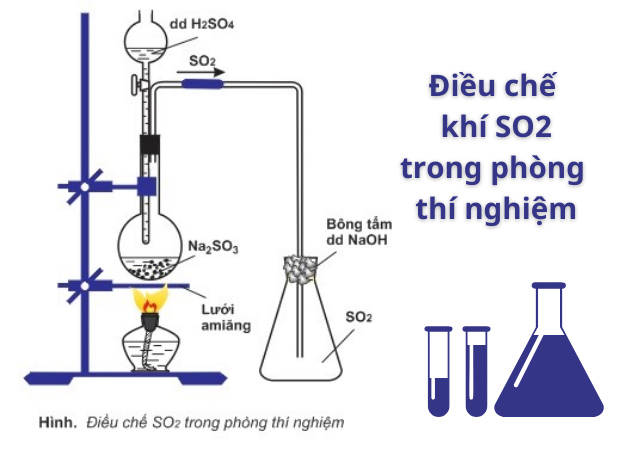
Phương pháp điều chế so2 trong phòng thí nghiệm
Cách điều chế SO2 trong phòng thí nghiệm được thực hiện theo cách khá đơn giản. Chúng ta cho Natri sunfit tác dụng với axit sunfuric để sinh ra khí SO2. Phương trình như sau:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
 Hoặc hoàn toàn có thể điều chế bằng cách cho Natri sunfit tính năng với Axit clohydric :
Hoặc hoàn toàn có thể điều chế bằng cách cho Natri sunfit tính năng với Axit clohydric :
Phương trình như sau : Na2SO3 + 2HC l → 2N aCl + H2O + SO2
Cho đồng ( Cu ) phản ứng H2SO4 đặc nóng : Cu + 2H2 SO4 → CuSO4 + SO2 + 2H2 O
Ngoài cách điều chế ở phòng thí nghiệm, để sản xuất khí SO2 nhanh hơn thì người ta triển khai đốt lưu huỳnh : S + O2 ( to ) → SO2
Đốt cháy H2S ( Hydro Sunfua ) trong oxi dư : 2H2 S + 3O2 → 2H2 O + 2SO2
Đốt quặng Pirit Sắt: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Các ứng dụng của khí SO2 trong các lĩnh vực sản xuất
Khí SO2 được ứng dụng rất nhiều trong những nghành sản xuất và đời sống. Nó được dùng để sản xuất Axit Sunfuric, sản xuất bột giấy, sản xuất dung dịch đường, dữ gìn và bảo vệ những loại thực phẩm sấy khô, sản xuất rượu, … Trong phòng thí nghiệm, SO2 được ứng dụng để nhận ra một số ít hợp chất .

Có thể nói SO2 là một chất độc, gây ô nhiễm môi trường không khí. Tuy nhiên nó vẫn được sản xuất thường xuyên để phục vụ mục đích công nghiệp, là một trong những mắt xích quan trọng. Trên đây chúng tôi đã giải thích cho bạn đọc cách điều chế SO2 trong phòng thí nghiệm cụ thể nhất. Hãy theo dõi chúng tôi để cập nhật các kiến thức thường xuyên hơn nhé.
| | Xem thêm bài viết khác :
Source: http://wp.ftn61.com
Category: Hỏi Đáp



Để lại một bình luận