Tóm tắt nội dung bài viết
1. Phương trình phản ứng Al tính năng với HNO3 loãng ra NH4NO3
8A l + 30HNO3 → 8A l ( NO3 ) 3 + 3NH4 NO3 + 9H2 O
2. Cân bằng phản ứng Al + HNO3 → Al ( NO3 ) 3 + NH4NO3 + H2O
Sử dụng phương pháp thăng bằng electron cân bằng phản ứng oxi hóa khử Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Al0 + HN + 5O3 → Al + 3 ( NO3 ) 3 + N-3H4NO3 + H2OBạn đang xem : Al + HNO3 → Al ( NO3 ) 3 + NH4NO3 + H2O

Điền thông số 8 vào Al, Al + 3 ; điền thông số 3 vào N-3
Vậy phương trình phản ứng : 8A l + 30HNO3 → 8A l ( NO3 ) 3 + 3NH4 NO3 + 9H2 O
4. Điều kiện Al công dụng với HNO3
Nhiệt độ phòng
3. Bài tập vận dụng tương quan
Câu 1. Cho phản ứng hoá học sau:
Al + HNO3 → Al ( NO3 ) 3 + NH4NO3 + H2O
Tổng thông số cân bằng ( là số nguyên, tối giản ) của phản ứng trên là :
A. 58
B. 60
C. 48
D. 62
Đáp án A
Câu 2. Thuốc thử dùng để nhận biết ba axit đặc nguội HNO3, H2SO4, HCl đựng trong ba lọ mất nhãn:
A. Cu
B. Al
C. Cr
D. CuO
Đáp án A
Câu 3. Hòa tan hoàn toàn 6,5 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch A và 0,224 lít khí N2 (đktc). Khối lượng muối trong dung dịch A là
A. 18,90 gam
B. 19,9 gam
C. 39,80 gam
Xem thêm: Bộ Kế hoạch Đầu tư Tiếng Anh là gì?
D. 28,35 gam
Đáp án B
nZn = 6,5 / 65 = 0,1 ( mol ) ;
nN2 = 0,224 / 22,4 = 0,01 ( mol )
Ta thấy :
necho = 2 nZn = 0,2 ( mol ) > nenhan = 10 nN2 = 0,1 ( mol )
→ Sản phẩm khử có chứa NH4NO3
Quá trình cho – nhận e :
0Z n → + 2Z n + 2 e 2N + 5 + 10 e → 2N0 ( N2 )
2N + 5 + 8 e → N-3 ( NH4NO3 )
Áp dụng bảo toàn e :
2 nZn = 10 nN2 + 8 nNH4NO3
⇔ 2.0,1 = 10.0,01 + 8 nNH4NO3
⇔ nNH4NO3 = 0,0125 ( mol )
Muối trong dung dịch A gồm :
0,1 mol Zn ( NO3 ) 2 và 0,0125 mol NH4NO3
→ mmuối = 0,1. 189 + 0,0125. 80 = 19,9 gam
Câu 4. Trong phòng thí nghiệm, người ta thường điều chế HNO3 từ
A. NaNO2 và H2SO4 đặc .
B. NaNO3 và H2SO4 đặc .
C. NH3 và O2 .
D. N2O5 và H2O .
Đáp án B
… … … … … … … … … … … … … … .
Trên đây THPT Sóc Trăng vừa trình làng tới những bạn phương trình phản ứng Al + HNO3 → Al ( NO3 ) 3 + NH4NO3 + H2O, mong rằng qua bài viết này những bạn hoàn toàn có thể học tập tốt hơn môn Hóa học lớp 11. Mời những bạn cùng tìm hiểu thêm thêm kỹ năng và kiến thức những môn Toán 11, Ngữ văn 11, Tiếng Anh 11, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11 …
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, THPT Sóc Trăng mời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.
Đăng bởi : trung học phổ thông Sóc Trăng
Chuyên mục : Giáo dục đào tạo
Source: http://wp.ftn61.com
Category: Hỏi Đáp

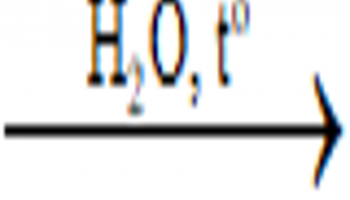

Để lại một bình luận