Tóm tắt nội dung bài viết
Chuyên đề nhận biết các chất
1. Lý thuyết
a. Với chất khí.
- CO2: Nước vôi trong dư -> Đục nước vôi trong.
- SO2 (Mùi hắc): Dung dịch brom(Br2) -> mất màu vàng của dung dịch brom. (SO2 + Br2 +2H2O-> HBr + H2SO4)
- NH3 (mùi khai): Quỳ tím ẩm hóa xanh.
- Cl2 (màu vàng): Dung dịch KI và hồ tinh bột -> Dung dịch màu xanh; Quỳ tím ẩm -> Đỏ, sau đó mất màu.
- H2S (mùi trứng thối): Dung dịch Pb(NO3)2 -> Kết tủa đen.
- HCl: Quỳ tím ẩm -> Hóa đỏ; Dung dịch AgNO3 -> Kết tủa trắng.
- N2: Que diêm có tàn đỏ -> Tắt.
- NO: Để ngoài không khí hóa màu nâu đỏ.
- NO2: Màu nâu đỏ, quỳ tím ẩm hóa đỏ.
b. Dung dịch bazơ.
- Ca(OH)2: Dùng CO2, SO2: Có kết tủa trắng ( Nếu sục đến dư kết tủa tan ra).
- Ba(OH)2: Dùng dịch H2SO4 -> Kết tủa màu trắng.
c. Dung dịch axit.
Bạn đang đọc: Tổng hợp nhận biết các chất bằng phương pháp hóa học | Bán Máy Nước Nóng – Banmaynuocnong
- HCl: Dùng dung dịch AgNO3 -> Kết tủa trắng.
- H2SO4: Dùng dung dịch BaCl2 -> Kết tủa trắng.
- HNO3: Dùng bột Cu và đun ở nhiệt độ cao -> Dung dịch màu xanh, khí màu nâu đỏ thoát ra.
d. Dung dịch muối.
- Muối clorua(-Cl): Dùng dung dịch AgNO3 -> Kết tủa trắng
- Muối sunfat: Dùng dung dịch BaCl2 -> kết tủa trắng.
- Muối cacbonat(=CO3):Dùng dung dịch axit (HCl, H2SO4 -> Khí
- Muối sunfua (=S): Dùng dung dịch Pb(NO3)2 -> Kết tủa màu đen.
- Muối photphat (PO4): Dùng dung dịch AgNO3 -> Kết tủa màu vàng
e. Các oxit của kim loại
Thường hòa tan vào nước -> Chia làm 2 nhóm : Tan trong nước và không tan trong nước .
– Nhóm tan trong nước cho tính năng với CO2 ( Nếu thử bằng quỳ tím -> Đỏ )
+ Nếu không có kết tủa : Kim loại tring oxit là sắt kẽm kim loại kiềm ( Hóa trị I ) .
+ Nếu có kết tủa : sắt kẽm kim loại trong oxit là sắt kẽm kim loại kiềm thổ ( Hóa trị II ) .
– Nhóm không tan trong nước cho tính năng với dung dịch bazơ ( NaOH ) .
+ Nếu tan trong dung dịch kiềm thì sắt kẽm kim loại trong oxit là Al, Zn, Cr .
+ Nếu không tan trong dung dịch kiềm thì là sắt kẽm kim loại khác .
Các oxit của phi kim : Cho vào nước thử bằng quỳ tím -> Xanh .


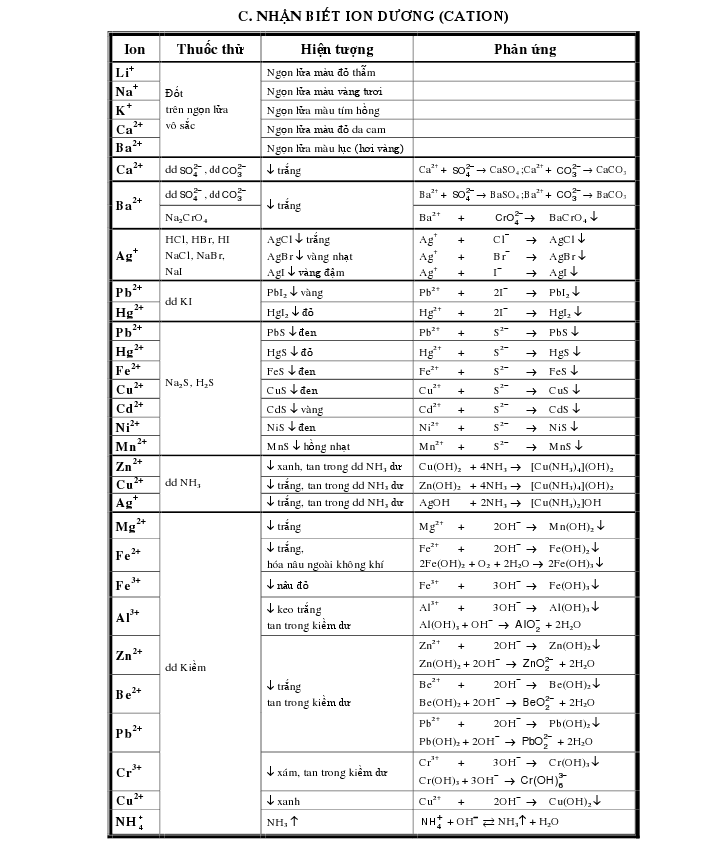

Chuyên đề nhận biết các chất
2. Bài tập
Vần đề 1: Nhận biết các chất dựa vào tính chất vật lý.
– Loại bài tập này hoàn toàn có thể dựa vào đặc thù vật lý khác nhau như : màu, mùi vị, tính tan .
– Các đặc trưng của các chất như : CO2 không cháy, sắt bị nam châm hút hút, Khí NH3 có mùi khai, khí H2S có mùi trứng thối, ..
Bài 1: Dựa vào tính chất vật lý hãy phân biệt 2 chất bột: AgCl và AgNO3.
BL : + Lấy một chút ít mỗi chất trên làm mẫu thử .
+ Cho 2 mẫu thử trên vào nước, chất bột nào tan trong nước là AgNO3, chất nào không tan trong nước là AgCl .
Bài 2: Phân biệt các chất bột: AgNO3, Fe và Cu dựa vào tính chất vật lý.
Bài 3: Phân biệt 3 chất khí: Cl2, O2, CO2 dựa vào tính chất vật lý của chúng.
Bài 4: Dựa vào tính chất vật lý hãy phân biệt các chất chứa trong lọ mất nhãn:
- a) Bột sắt, bột lưu huỳnh, bột đồng oxit. b) Khí CO2, khí H2S, khí NH3.
- c) Khí H2, Cl2, H2S d) Các chất bột trắng là: Đường, muối ăn, tinh bột.
- e) Khí O2, Khí Cl2, khí N2. f) Khí NH3, O2, Cl2, CO2
Chuyên đề nhận biết các chất
Vấn đề 2: Nhận biết các chất dựa vào tính chất hóa học.
Dạng 1: Nhận biết bằng thuốc thử tùy chọn.
a) Nhận biết các chất rắn: Thường cho các chất rắn hòa tan vào nước sau đó nhận biết sản phẩm thu được.
Bài 1: Bằng phương pháp hóa học hãy phân biệt các chất rắn sau:
a ) CaO và Na2O b ) CaO và CaCO3 c ) CaO và MgO d ) CaO và P2O5
e ) Al và Fe. f ) Al, Fe và Ag g ) NaCl, NaNO3, BaCO3, BaSO4. h ) Na2CO3, MgCO3, BaCO3
Bài 2: Bằng phương pháp hóa học hãy phân biệt các chất bột trắng sau:
a ) Tinh bột, xenlulozơ, saccarozơ .
b ) Tinh bột, glucozơ, saccarozơ .
b) Nhận biết các chất khí: Thường dẫn các khí đó vào thuốc thử để nhận biết.
Bài 1: Bằng phương pháp hóa học hãy nhận biết các khí sau:
a ) CO2 và O2 b ) SO2 và O2 c ) CO2 và SO2 .
d ) Cl2, HCl, O2. e ) CO2, Cl2, CO, H2 f ) CO2, SO2, O2, NH3, C2H2, C2H4
Bài 2: Nhận biết các khí sau bằng phương pháp hóa học:
a ) CO2, CH4 và C2H2 b ) CH4 và C2H4. c ) CH4, C2H4, C2H2 d ) CH4, CO2, C2H2, O2
c) Nhận biết các chất trong dung dịch: Thường lấy các chất đó cho vào thuốc thử.
Bài 1: Trình bày phương pháp hóa học phân biệt các dung dịch sau:
a ) HCl và H2SO4 b ) HCl, H2SO4, HNO3. c ) HCl, H2SO4, HNO3, H2
d ) HCl, H2SO4, HNO3, H3PO4. e ) HCl, H2SO4, HNO3, H3PO4, H2O
Bài 2: Phân biệt các dung dịch sau bằng phương pháp hóa học:
a ) NaCl và Na2SO4 .
b ) NaCl, Na2SO4, NaNO3 .
c ) Na2SO4 và CuSO4 .
d ) Na2SO4, CuSO4, NaCl .
e ) CuSO4, AgNO3, NaCl
f ) K2SO4 và Fe2 ( SO4 ) 3 .
g ) K2SO4. FeSO4, Fe2 ( SO4 ) 3
h ) MgSO4, Na2SO4, FeSO4, CuSO4
i ) FeSO4, Fe2 ( SO4 ) 3, MgSO4
Bài 3: Trình bày phương pháp hóa học phân biệt các dung dịch sau:
a ) Na2SO4 và H2SO4
b ) Na2SO4, H2SO4, NaCl .
c ) NaCl, Na2SO4, H2SO4
d ) NaCl, HCl, H2SO4
e ) Na2SO4, H2SO4, HCl
f ) Na2SO4, NaCl, H2SO4, HCl
Bài 4: Hãy nhận biết các ống nghiệm mất nhãn chứa một các dung dịch sau:
a ) Na2CO3, NaOH, NaCl, HCl .
b ) HCl, NaOH, Na2SO4, NaCl, NaNO3 .
c ) NaNO3, Mg ( NO3 ) 2, Fe ( NO3 ) 2, Cu ( NO3 ) 2
d ) Na2CO3, NH4NO3, HCl, FeCl2
e ) NaCl, NaNO3, Na2SO4, Na2S, Na2CO3, Na2SO3
f ) FeSO4 ; Fe2 ( SO4 ) 3 và MgSO4
Bài 5: Nêu phương pháp hóa học để phân biệt 2 dung dịch: Glucozơ và rượu etylic.
Bài 6: Có 2 lọ mất nhãn đựng 2 dung dịch không màu: CH3COOH, C2H5OH. Hãy trình bày
Bài 7: Có 3 chất lỏng là: Rượu etylic, axit axetic, và dầu ăn tan trong rượu. Bằng phương pháp hóa học hãy phân biệt 2 chất lỏng trên phương pháp hóa học để nhận biết chúng.
Bài 8: Có 3 chất lỏng là: Rượu tylic, axit axetic và glucozơ. Bằng phương pháp hóa học hãy phân biệt 2 chất lỏng trên.
Bài 9: Có các chất lỏng (dung dịch) đựng riêng biệt trong mỗi lọ: CH3COOH, C6H6, C2H5OH, C6H12O6. Bằng phương pháp hóa học, hãy trình bày cách nhận biết chất lỏng, viết phương trình phản ứng xảy ra.
Chuyên đề nhận biết các chất
Dạng 2: Nhận biết bằng thuốc thử quy định
– Trường hợp này không dùng nhiều thuốc thử mà chỉ dùng thuốc thử theo quy định của đề bài.
– Muốn vậy, ta dùng thuốc thử đó để tìm ra một trong số các lọ đã cho, lọ tìm được này chính là thuốc thử cho các lọ còn lại .
Bài 1: Chỉ dùng quỳ tím, hãy nhận biết các ống nghiệm mất nhãn chứa các dung dịch sau:
a ) H2SO4, Na2SO4, BaCl2 .
b ) H2SO4, Na2SO4, BaCl2, NaCl .
c ) NaOH, HCl, H2O d ) HCl, H2SO4, BaCl2
e ) Na2SO4, H2SO4, NaOH f ) Na2SO4, Na2CO3, H2SO4, BaCl2
g ) NaCl, H2SO4, NaOH h ) HCl, NaCl, Na2CO3, BaCl2 .
Bài 2: Chỉ dùng thêm quỷ tím hãy phân biệt các dung dịch chứa tròn các lọ riêng biệt sau:
a ) NaOH, AgNO3, HCl, HNO3, H2
b ) Na2CO3, NaOH, HCl, Ba ( OH ) 2 .
c ) H2SO4, NaOH, BaCl2, ( NH4 ) 2SO4
d ) CuCl2, NaOH, NaCl, AlCl3 .
e ) Na2SO4, Na2CO3, NaCl, H2SO4, BaCl2, NaOH .
f ) HCl, Na2CO3, AgNO3, BaCl2 .
g ) NaHSO4, Na2CO3, Na2SO3, BaCl2, Na2S
h ) BaCl2, NH4Cl ; ( NH4 ) SO4 ; NaOH ; Na2CO3
Bài 3: Chỉ được dùng thêm 1 thuốc thử khác, hãy nhận biết các chất sau:
a ) Na2CO3, HCl, Ba ( NO3 ) 2
b ) Na2SO4, Na2CO3, H2SO4, BaCl2 .
c ) Na2CO3, HCl, Ba ( NO3 ) 2, Na2SO4
d ) Ba ( OH ) 2, NH4Cl, HCl, ( NH4 ) 2SO4
e ) FeCl2, FeCl3, NaOH, HCl .
f ) Na2CO3, BaCl2, H2SO4 .
g ) H2SO4, Ba ( NO3 ) 2, KCl, Na2
h ) HCl, NaOH, AgNO3, CuSO4 .
i ) MgCl2, FeCl2, FeCl3, AlCl3
j ) H2SO4, Na2SO4, Na2CO3, MgSO4
k ) HCl, H2SO4, BaCl2
l ) NH4HSO4, Ba ( OH ) 2, BaCl2, HCl, NaCl và H2SO4
Bài 4: Chỉ dùng dung dịch HCl hãy phân biệt các chất sau:
a ) NaCl, Na2CO3, BaSO4, BaCO3
b ) Fe, FeO, Cu
c ) Cu, CuO, Zn .
d ) NaCl, Na2CO3, MgSO4, NaOH
Bài 5: Chỉ dùng dung dịch brom hãy nhận biết các khí sau:
a ) CH4 vàC2H4 .
b ) CH4 và C2H2
c ) C2H4 và C2H2 .
d ) CO2, C2H4, C2H2
Bài 6: Chỉ dùng dung dịch NaOH hãy phân biệt các dung dịch:
a ) NaCl, NH4Cl, MgCl2, FeCl3, AlCl3 .
b ) FeSO4 ; Fe2 ( SO4 ) 3 và MgSO4
c ) K2CO3, MgSO4, Al2 ( SO4 ) 3, FeSO4 và Fe2 ( SO4 ) 3
Bài 7: Chỉ dùng dung dịch H2SO4 hãy phân biệt các chất sau:
a ) NaCl, Na2S, Na2SO3, Na2CO3 .
b ) Ba, BaO, Al, Al2O3
c ) Mg, Zn, Fe, Ba .
Bài 8: Chỉ dùng một kim loại hãy phân biệt các dung dịch sau: Na2SO4, Na2CO3, HCl, Ba(NO3)2
Bài 9: Chỉ dùng thêm nước hãy nhận biết các chất sau: Na, MgCl2, FeCl2, FeCl3, AlCl3.
Bài 10: Nhận biết các dung dịch sau NaHSO 4, KHCO3, Mg(HCO3)2, Na2SO3, Ba(HCO3)2, bằng cách đun nóng và cho tác dụng lẫn nhau.
Bài 11: Trình bày cách nhận biết các chất sau đây bằng 2 thuốc thử: C2H4, C2H2, C2H6, CO2, SO2.
Dạng 3: Nhận biết không có thuốc thử khác.
– Trường hợp này bắt buộc phải lấy cho phản ứng với các lọ còn lại .
– Để tiện so sánh ta nên kẻ bảng phản ứng. Khi ấy ứng với mỗi lọ sẽ có những hiện tượng kỳ lạ phản ứng khác nhau. Đây chính là cơ sở để phân biệt từng lọ .
Bài 1 : Không dùng thêm thuốc thử nào khác, hãy nhận biết các ống nghiệm mất nhãn đựng các dung dịch :
a ) Na2CO3, HCl, BaCl2 .
b ) MgCl2, BaCl2, H2SO4, K2CO3 .
c ) Na2SO4, MgSO4, CuSO4, Ba ( OH ) 2
d ) NaCl, H2SO4, CuSO4, BaCl2, NaOH
e ) NaOH, FeCl2, HCl, NaCl
f ) CaCl2, HCl, Na2CO3, ( NH4 ) 2CO3
g ) HCl, NaCl, Ba ( OH ) 2, Ba ( HCO3 ) 2, Na2CO3
h ) Cu ( NO3 ) 2, Ba ( OH ) 2, HCl, AlCl3, H2SO4
n ) HCl, NaOH, Na2CO3, MgCl2 .
m ) HCl, H2SO4, Na2SO4, BaCl2 .
Chuyên đề nhận biết các chất, Chuyên đề nhận biết các chất
Để xem tài liệu đầy đủ và chi tiết, mời các bạn CLICK vào ô tải về…..
Tải về – Chuyên đề nhận biết các chất: TẢI VỀ
Các bài viết khác :
Đề thi HSG môn Hóa 12 Tỉnh Vĩnh Phúc 2017 – 2018
Tuyển tập 100 đề thi HSG môn Hóa THCS
Đề thi HSG môn Hóa 9 huyện Gia Lộc-Hải Dương
Chuyên đề nhận biết các chất
Liên hệ: Facebook: Sinhh Quách
Fanpage: PageHoahocthcs
♥ Cảm ơn bạn đã xem : Chuyên đề nhận biết các chất, Chuyên đề nhận biết các chất, Chuyên đề nhận biết các chất, Chuyên đề nhận biết các chất, Chuyên đề nhận biết các chất, Chuyên đề nhận biết các chất, Chuyên đề nhận biết các chất, Chuyên đề nhận biết các chất, Chuyên đề nhận biết các chất, Chuyên đề nhận biết các chất
Source: http://wp.ftn61.com
Category: Hỏi Đáp



Để lại một bình luận