
Đang tải tool… Đợi tí!
Đang tải tool … Đợi tí !
Mẹo cho học sinh: Sau khi tải trang có thể ngắt mạng để cân bằng phương trình, hoặc tải trang web về để cân bằng offline
Đang tải tool … Đợi tí ! Đang tải tool … Đợi tí ! Mẹo cho học viên : Sau khi tải trang hoàn toàn có thể ngắt mạng để cân bằng phương trình, hoặc tải website về để cân bằng offline
| Kết quả |
|---|
|
Bạn đang đọc: Cân bằng phương trình phản ứng hóa học online trực tuyến – Sharescript Bạn đang đọc: Cân bằng phương trình phản ứng hóa học online trực tuyến – Sharescript – Hội Buôn Chuyện
|
Tóm tắt nội dung bài viết
- Hướng dẫn công cụ cân bằng phương trình phản ứng hóa học
- Cách cân bằng phương trình hóa học bằng tay thủ công nhanh và đúng chuẩn nhất
- 1. Dùng phương pháp nguyên tử nguyên tố
- 2. Dùng phương pháp hóa trị tác dụng
- 3. Dùng phương pháp hệ số phân số
- 4. Dùng phương pháp chẵn – lẻ
- 5. Dùng phương pháp xuất phát từ nguyên tố chung nhất
- 6. Dùng phương pháp cân bằng theo nguyên tố tiêu biểu
- 7. Dùng phương pháp cân bằng phương trình hóa học theo trình tự kim loại – phi kim
- 8. Dùng phương pháp cân bằng phản ứng cháy của chất hữu cơ
- 9. Dựa vào bản chất hóa học của phản ứng
- 10. Dùng phương pháp đại số
- 11. Dùng phương pháp cân bằng electron
- 12. Dùng phương pháp cân bằng ion – electron
Hướng dẫn công cụ cân bằng phương trình phản ứng hóa học
| Nhập vào | Tương đương | |
|---|---|---|
| Chỉ số | N = N2 |
N→N2 |
| Hợp chất | H2 + O2 = H2O |
H2 + O2→H2O |
| Nhóm | Mg(OH)2 = MgO + H2O |
Mg(OH)2→MgO + H2O |
| Ion | H^+ + CO3^2- = H2O + CO2 |
H+ + CO32−→H2O + CO2 |
| Electron | Fe^3+ + e = Fe |
Fe3+ + e−→Fe |
| Không dấu cách | A3^-+B2^2+=A5B+e |
A3− + B22+→A5B + e− |
| Có dấu cách | C 3 H 5 ( O H ) 3 + O 2 = H 2 O + C O 2 |
C3H5(OH)3 + O2→H2O + CO2 |
| Optional 1 | H1^1+ + e = H1^1- |
H+ + e−→H− |
| Ký tự linh hoạt | ^5+ + Bar^3- = Foo2 + Foo^- |
Foo5+ + Bar3−→FooBar2 + FooBar− |
Cách cân bằng phương trình hóa học bằng tay thủ công nhanh và đúng chuẩn nhất
1. Dùng phương pháp nguyên tử nguyên tố
Phương pháp này rất đơn thuần, ta sẽ viết những đơn chất khí ở dạng nguyên tử riêng không liên quan gì đến nhau. Tiếp theo lập luận qua một số ít bước. Ví dụ dưới đây :
2. Dùng phương pháp hóa trị tác dụng
Hóa trị công dụng là hóa trị của nguyên tử hoặc nhóm nguyên tử của những nguyên tố trong chất tham gia và chất tạo thành trong phản ứng hóa học .
Với phương pháp hóa trị tính năng này, ta hoàn toàn có thể triển khai những bước sau :
* Xác định hóa trị công dụng : BaCl2 + Fe2 ( SO4 ) 3 − − − > BaSO4 + FeCl3BaCl2 + Fe2 ( SO4 ) 3 − − − > BaSO4 + FeCl3
Theo đó, lần lượt từ trái qua phải sẽ có hóa trị công dụng lần lượt là : Ba ( II ) – Cl ( I ) – Fe ( III ) – SO4 ( II )
Tìm hóa trị tính năng với bội số chung nhỏ nhất – BSCNN ( 1,2,3 ) = 6. Theo đó, ta lấy BSCNN chia cho những hóa trị tìm những thông số tương ứng : 6/1 = 6 ; 6/2 = 3 ; 6/3 = 2. Sau đó thay vào phản ứng, ta được :
3B aCl2 + Fe2 ( SO4 ) 3 − − − > 3B aSO4 + 2F eCl33BaCl2 + Fe2 ( SO4 ) 3 − − − > 3B aSO4 + 2F eCl3
Tóm lại, tất cả chúng ta sẽ vận dụng giải pháp này để củng cố khái niệm bảng hóa trị, ghi nhớ hóa trị của những nguyên tô thường gặp và cách tính hóa trị .
3. Dùng phương pháp hệ số phân số
Ở những công thức của những chất tham gia phản ứng, bạn sẽ thay những thông số vào không phân biệt số nguyên hay phân số sao cho số nguyên tử của mỗi nguyên tố ở 2 vế phương trình bằng nhau. Tiếp theo, ở tổng thể những thông số, bạn sẽ thực thi khử mẫu số chung .
4. Dùng phương pháp chẵn – lẻ
Theo nguyên tắc, khi cân đối phương trình hóa học, số nguyên tử của nguyên tố ở cả 2 vế phương trình sẽ bằng nhau. Do đó, một phản ứng đã cân đối, nếu số nguyên tử của nguyên tốt ở vế trái hay phải là số chẵn thì vế còn lại cũng có số nguyên tử nguyên tố tựa như. Trong trường hợp, ở công thức hóa học nào đó có số nguyên tử nguyên tố lẻ thì phải thực thi nhân đôi .
5. Dùng phương pháp xuất phát từ nguyên tố chung nhất
Bạn sẽ khởi đầu cân đối thông số những phân tử bằng cách chọn nguyên tố góp mặt ở nhiều hợp chất nhất trong phản ứng được triển khai .
6. Dùng phương pháp cân bằng theo nguyên tố tiêu biểu
Những đặc trưng của nguyên tố tiêu biểu vượt trội tiêu biểu vượt trội gồm có :
- Ít có mặt nhất trong các chất tham gia phản ứng hóa học.
- Có liên quan gián tiếp nhiều nhất đến các chất tham gia phản ứng hóa học.
- Nguyên tử ở 2 về chưa cân bằng
- Cách để thực hiện phương pháp nguyên tố tiêu biểu để cân bằng phương trình hóa học như sau:
- Chọn ra nguyên tố tiêu biểu
- Cân bằng nguyên tố tiêu biểu
- Cân bằng các nguyên tố khác theo nguyên tố này.
Cho vídụ phương trình hóa học như sau : KMnO4 + HCl — > KCl + MnCl2 + Cl2 + H2O. Ta sẽ thực thi tuần tự như sau :
a. Chọn nguyên tố tiêu biểu vượt trội là O
b. Cân bằng nguyên tố tiêu biểu vượt trội : KMnO4 − − − − > 4H2 OKMnO4 − − − − > 4H2 O
c. Cân bằng những nguyên tố khác :
Cân bằng H : 4H2 O − > 8HC l4H2O − > 8HC l
Cân bầng Cl : 8HC l − > KCl + MnCl2 + 5/2 Cl − 28HC l − > KCl + MnCl2 + 5/2 Cl − 2
Từ đó ta có phương trình : KMnO4 + 8HC l − − − > KCl + MnCl2 + 5/2 Cl2 + 4H2 OKMnO4 + 8HC l − − − > KCl + MnCl2 + 5/2 Cl2 + 4H2 O
Nhân tổng thể với mẫu số chung là 2 ta có phương trình :
2KM nO4 + 16HC l − − − > 2KC l + 2M nCl2 + 5C l2 + 8H2 O2KMnO4 + 16HC l − − − > 2KC l + 2M nCl2 + 5C l2 + 8H2 O
7. Dùng phương pháp cân bằng phương trình hóa học theo trình tự kim loại – phi kim
Áp dụng giải pháp cân đối phương trình này, thứ nhất, bạn cân đối số nguyên tử sắt kẽm kim loại sau đó đến nguyên tử phi kim và sau cuối là Hidro. Sau đó, cân đối nguyên tử Oxy bằng cách đưa những thông số đã biết .
8. Dùng phương pháp cân bằng phản ứng cháy của chất hữu cơ
Ta sẽ có những cách cân đối theo giải pháp này như sau :
a. Dùng phản ứng cháy của hidrocacbon
Với phản ứng cháy này, bạn sẽ cân đối phương trình theo trình tự sau :
- Cân bằng số nguyên tử C
- Cân bằng số nguyên tử H
- Cân bằng số nguyên tử O
Trong đó, cân bằng số nguyên tử O sẽ thực thi bằng cách tính tổng số nguyên tử O ở về phải rồi đem chia cho 2 sẽ ra thông số 0 ở vế này. Nếu số lẻ, sẽ triển khai nhân toàn bộ những chất ở 2 vế với 2 .
Xem thêm : Cân Bằng Phương Trình Hóa Học Online Đầy Đủ Và Chi Tiết Nhất
b. Phản ứng cháy của hợp chất chứa O
Với cách cân đối phương trình này, bạn sẽ triển khai theo những trình tự sau :
* Cân bằng số nguyên tử C
* Cân bằng số nguyên tử H
* Cân bằng số nguyên tử O trải qua tính số nguyên tử O ở vế phải. Tiếp theo, trong hợp chất, bạn trừ đi số nguyên tử O. Lấy tác dụng chia cho 2 sẽ ra thông số của phân tử O2. Ta sẽ thực thi nhân đôi cả 2 vế của phương trình nếu hệ số lẻ để khử mẫu số .
9. Dựa vào bản chất hóa học của phản ứng
Với chiêu thức này, bạn sẽ lập luận dựa vào thực chất của phản ứng để cân đối phương trình .

10. Dùng phương pháp đại số
Về nguyên tắc, ở cả 2 vế, số nguyên tử của mỗi nguyên tố phải bằng nhau. Do đó, những bước cân đối phương trình hóa học bằng đại số triển khai qua những bước :
Xem thêm: Bộ Kế hoạch Đầu tư Tiếng Anh là gì?
- Đặt các hệ số hợp thức là ẩn số
- Cân bằng nguyên tố và lập phương trình đại số dựa vào định luật bảo toàn khối lượng.
- Chọn nghiệm tùy ý cho một ẩn, sau đó dùng hệ phương trình đại số để suy ra các ẩn số còn lại
11. Dùng phương pháp cân bằng electron
Về nguyên tắc, tổng số electron của chất khử cho phải bằng tổng số electron chất oxi hóa nhận theo sự bảo toàn electron. Thực hiện giải pháp cân đối electron qua những bước sau :
* Bước 1: Các nguyên tố có sự thay đổi số oxi hóa thể hiện bằng sơ đồ phản ứng.
* Bước 2: Viết các quá trình khử cho electron và oxi hóa nhận electron
* Bước 3: Nhân hệ số để thực hiện cân bằng electron như sau:
+ Tổng số electron nhận = tổng số electron cho
+ Tổng số oxi hóa giảm = tổng số oxi hóa tăng
+ Tổng số oxi hóa giảm = tổng số oxi hóa tăng )
* Bước 4: Nếu không thay đổi số oxi hóa sẽ cân bằng nguyên tố thực hiện theo thứ tự:
+ Kim loại ( ion dương )
+ Gốc axit ( ion âm )
+ Môi trường axit hay bazơ
+ Nước ( cân đối hidro bằng cách cân đối H20 )
* Bước 5: Số nguyên tử oxi ở hai vế phải bằng nhau nên bạn cần kiểm tra lại.
Lưu ý: Bạn cần chú ý chỉ số quy định của nguyên tố đó một cách chính xác khi viết các quá trình oxi hóa và quá trình khử của từng nguyên tố.
12. Dùng phương pháp cân bằng ion – electron
Phương pháp này vận dụng cho những quy trình tiến độ xảy ra trong dung dịch với sự tham gia của những thiên nhiên và môi trường tự nhiên như dung dịch axit, H20 hoặc bazơ .
- Chú ý tới các nguyên tắc:
+ Khi axit tham gia phản ứng : sẽ thêm H + để tạo H20 .
+ Khi bazơ tham gia phản ứng : Phải thêm H20 vào vế nào thừa 0 để tạo ra 0H –
- Thực hiện áp dụng phương pháp này theo các bước:
Bước 1: Xác định các nguyên tố có số oxi hóa thay đổi và viết các nửa phản ứng oxi hóa – khử.
Bước 2: Cân bằng các bán phản ứng:
* Cân bằng số nguyên tử mỗi nguyên tố ở cả hai vế bằng cách :
+ Thêm H + hay OH –
+ Thêm H2O để cân đối số nguyên tử hidro
+ Kiểm soát số nguyên tử oxi ở hai vế ( phải bằng nhau )
* Thêm electron vào mỗi nửa phản ứng để cân đối điện tích .
Bước 3: Nhân hệ số để thực hiện cân bằng electron:
+ Tổng số electron cho sẽ bằng tổng số electron nhận
+ Tổng số oxi hóa giảm bằng tổng số oxi hóa tăng
Bước 4: Phương trình ion thu gọn cộng các nửa phản ứng.
Bước 5: Muốn chuyển thành phương trình ion đầy đủ từ phương trình dạng ion thu gọn, ta sẽ cộng phương trình phân tử vào hai vế những lượng bằng nhau các anion hoặc cation để bù trừ điện tích.
Nguồn : vieclam123.vn
Nguồn : vieclam123.vn
Source: http://wp.ftn61.com
Category: Hỏi Đáp





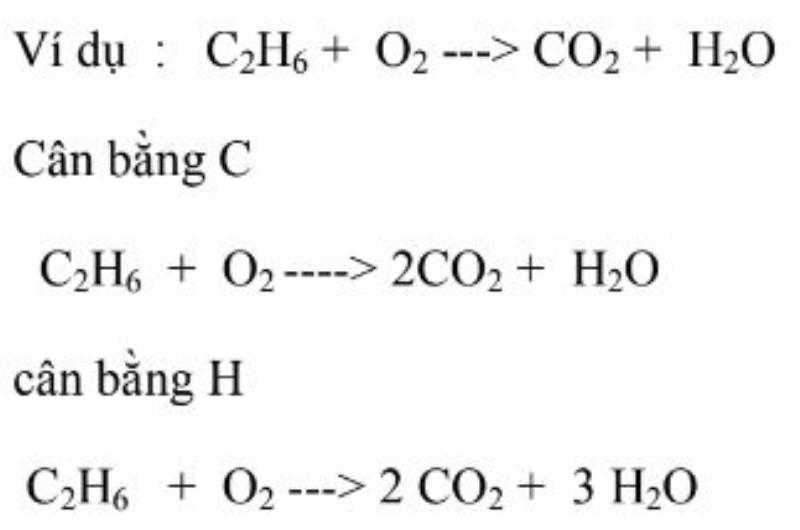

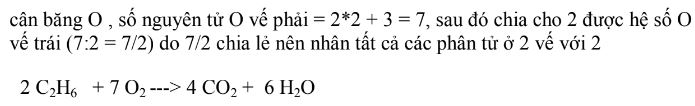


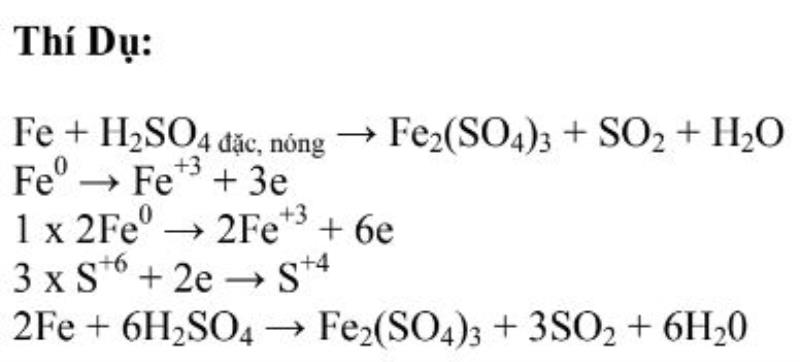

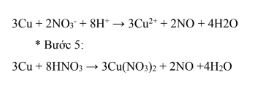



Để lại một bình luận